
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于阴影3区域的是( )
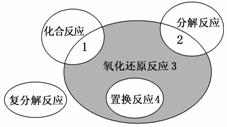
A.Cl2+2NaI===2NaCl+I2
B.NH4HCO3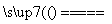 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.Fe2O3+3CO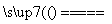 2Fe+3CO2
2Fe+3CO2
科目:高中化学 来源: 题型:
消去反应是有机化学中一类重要的反应类型。下列醇类物质能发生消去反应的是( )
①甲醇 ②1丙醇 ③1丁醇 ④2丁醇 ⑤2,2二甲基1丙醇 ⑥2戊醇 ⑦环己醇
A.①⑤ B.②③④⑥⑦
C.②③④⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到目的的是( )
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。
| 0.01 mol·L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(1)X、W的化学式分别为________、________。
(2)W在溶液中的电离方程式为________________________________________________________________________。
(3)25 ℃时,Z溶液的pH>7的原因是__________________________(用离子方程式表示)。
(4)将X、Y、Z各1 mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为____________________________________________。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为____________________________________________。
8.(1)NaOH NH4NO3
(2)NH4NO3===NH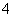 +NO
+NO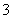
(3)NO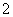 +H2O
+H2O
 HNO2+OH-
HNO2+OH-
(4)c(Na+)>c(NO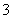 )>c(NO
)>c(NO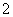 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
(5)NaNO2+NH4NO3===NaNO3+N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O===H2SO4+2HBr相比较,水的作用不相同的是( )
A. 2Na2O2+2H2O===4NaOH+O2↑
B.Fe(OH)2+O2+2H2O===4Fe(OH)3
C.2F2+2H2O===4HF+O2
D.2Al+2NaOH+2H2O===2NaAlO2+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
向某FeBr2溶液中,通入1.12 L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3 mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是( )
A.原溶液的浓度为0.1 mol/L
B.反应后溶液中c(Fe3+)=0.1 mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+)
D.原溶液中c(Br-)=0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)类比法是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2,为了验证该观点是否正确,该同学将一定量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
①提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
 假设3:该固体物质是__________________。
假设3:该固体物质是__________________。
②设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:
| 实验方法 | 实验现象 | 结 |
| 在溶液中加KSCN溶液 | 固体物质中有FeCl3 | |
| 在KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含________ |
③根据上述实验结论,写出Cl2与铁粉加热时反应的化学方程式_________________。
(2)为了进一步探究FeCl3溶液的性质,该同学又利用A溶液作了如下一些实验,其中正确的是________。
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.在A溶液中加入淀粉KI溶液,溶液变蓝
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.在A溶液中加入Fe、Cu固体后,充分反应后剩余固体中不可能有Fe无Cu
E.将A溶液加热蒸干并灼烧,得到FeCl3固体
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤: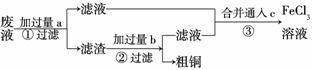
写出一个能证明还原性Fe比Cu强的 离子方程式:________
离子方程式:________ _______________________
_______________________
________________________________________________________________________。该反应在上图步骤
________中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。

上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及主要的电极反应式________________________________________________
_______________________________________________________ _________________。
_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对某些问题的认识正确的是
A.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
B.配制0.1mol/L的硫酸铜溶液450mL,需要托盘天平称量胆矾11.3g
C.不能用带玻璃塞的玻璃瓶和酸式滴定管盛取碱液,二者的原因是相同的
D.12C和14C 与O2和O3,两组物质的相互关系是相同的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com