
| A. | 电负性:X<Y | |
| B. | 周期表中,X可能在Y的右边 | |
| C. | 若X与Y形成化合物,则X显正价,Y显负价 | |
| D. | 气态氢化物的稳定性:HmY强于HnX |
分析 X、Y为同周期元素,且第一电离能X<Y,同周期随原子序数增大,第一电离能呈增大趋势,但ⅡA族、ⅤA族元素第一电离能大于同周期相邻元素,故则原子序数X<Y或X>Y.
A.同周期随原子序数增大,电负性增大;
B.ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素;
C.电负性大的元素原子对键合电子吸引力更大,化合物中显负价;
D.非金属性越强,气态氢化物越稳定.
解答 解:X、Y为同周期元素,且第一电离能X<Y,同周期随原子序数增大,第一电离能呈增大趋势,但ⅡA族、ⅤA族元素第一电离能共有同周期相邻元素,故则原子序数X<Y或X>Y.
A.原子序数可能是X<Y或X>Y,同周期随原子序数增大,电负性增大,故电负性:X<Y或X>Y,故A错误;
B.由于ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素,周期表中,X可能在Y的右边,也可能在Y的左边,故B正确;
C.电负性可能为:X<Y或X>Y,电负性大的元素原子对键合电子吸引力更大,化合物中显负价,故X与Y形成化合物中X显正价、Y显负价或X显负价、Y显正极,故C错误;
D.同周期自左而右非金属性增强,故非金属性:可能是X<Y或X>Y,非金属性越强,气态氢化物越稳定,故气态氢化物的稳定性:HmY强于HnX或HmY弱于HnX,故D错误,
故选B.
点评 本题考查位置结构性质关系应用,侧重对电离能的考查,注意理解掌握同周期元素第一电离能异常情况,学生容易忽略“ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素”,属于易错题目,难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知草酸氢钾溶液呈酸性,则在amol•L-1 KHC2O4溶液中,c(C2O42-)<c(H2C2O4) | |
| B. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2mol H2、l mol CO | 1mol CH3OH | 2mol CH3OH | |
| 平 | c(CH,0H)/mol/L | C1 | C2 | c3 |
| 衡 | 反应的能量变化ZkJ | x | y | z |
| 数 | 体系压强/Pa | P1 | P2 | P3 |
| 据 | 反应物转化率 | a1 | a2 | a3 |
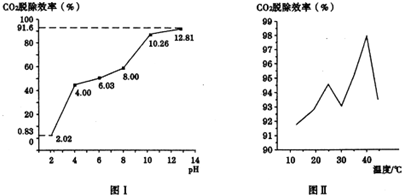
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) | (11) | (12) |
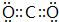
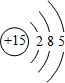 .
.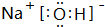 含有化学键为离子键、共价键
含有化学键为离子键、共价键查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,元素B在周期表中的位置2周期ⅥA族.
,元素B在周期表中的位置2周期ⅥA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Z>X>Y | C. | X>Z>Y | D. | Y>X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 酸性强弱:H2CO3<H2SiO3<HNO3 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 非金属性强弱:P>S>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾与钠同一主族,钠比钾更容易从水中置换出氢 | |
| B. | 溴化钾与碘化钾溶液置于空气中,溴化钾更容易被氧化 | |
| C. | 过渡元素都是副族元素 | |
| D. | 同周期元素的原子,半径越大,越容易失去电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com