
 铁及其化合物应用广泛,例如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
铁及其化合物应用广泛,例如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等. ,故答案为:
,故答案为: ;Fe3++e-=Fe2+;
;Fe3++e-=Fe2+;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次 序编号 | 盐酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
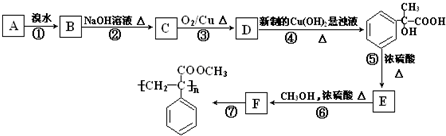
查看答案和解析>>
科目:高中化学 来源: 题型:
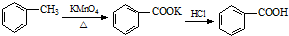
| 名称 | 性状 | 熔点 (℃) | 沸点 (℃) | 密度 (g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |
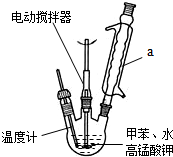 装置a的作用是
装置a的作用是 +
+ +
+查看答案和解析>>
科目:高中化学 来源: 题型:
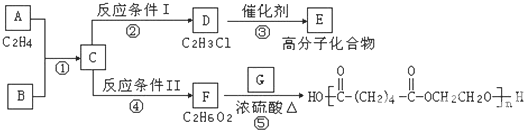
查看答案和解析>>
科目:高中化学 来源: 题型:
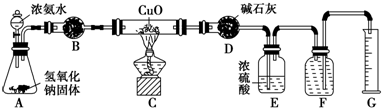 氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:
氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):
某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③④①② |
| C、④①③② | D、②①④③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com