
| A. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| C. | 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH-+HCO3-═BaCO3↓+2H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
分析 A.醋酸为弱酸,离子方程式中醋酸不能拆开;
B.硫离子的水解分步进行,且水解程度较小,不能用气体符号;
C.氢氧化钡少量,离子方程式按照氢氧化钡的化学式组成书写;
D.FeO42-与氢离子反应生成铁离子和氧气.
解答 解:A.碳酸钙和醋酸都需要保留化学式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故A错误;
B.硫化钠水溶液中,硫离子的水解主要以第一步为主,正确的离子方程式为:S2-+H2O?HS-+OH-,故B错误;
C.向NaHCO3溶液中加入少量的Ba(OH)2溶液,反应生成碳酸钠、碳酸钡沉淀和水,正确的离子方程式为:Ba2++2OH-+2HCO3-═BaCO3↓+2H2O+CO32-,故C错误;
D.向Na2FeO4溶液中加入稀硫酸产生氧气,反应的离子方程式为:4FeO42-+20H+═4Fe3++3O2↑+10H2O,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液和胶体的本质区别为是否能产生丁达尔效应 | |
| B. | K2Cr2O7溶液和氢溴酸能存放于同一药品橱内 | |
| C. | 用带玻璃塞的细口试剂瓶保存氢氟酸 | |
| D. | CH4和C2H4均属于常用危险品中的易燃气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
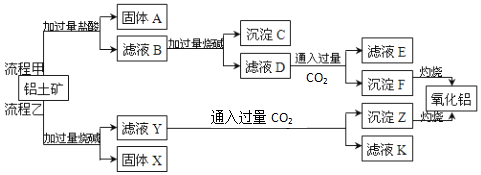
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
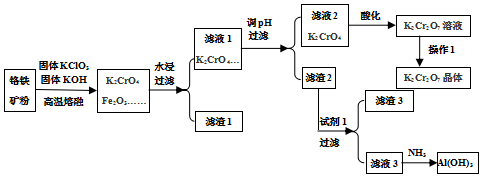
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-12mol/L,的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | PH=0的溶液中:Al3+、Ag(NH3)2+、I-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
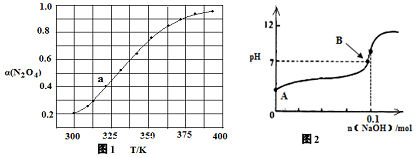
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制作印刷电路板:Fe3++Cu═Cu2++Fe2+ | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Ca(OH)2溶液与足量Ca(HCO3)2溶液反应:Ca2++2HCO3-+2OH-═2CaCO3↓+2H2O+CO32- | |
| D. | 新制饱和氯水中加入石灰石可提高溶液中HClO浓度:CaCO3+2Cl2+H2O═Ca2++2Cl-+CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>X>Y>Z>M | |
| B. | XZ2为直线形的共价化合物 | |
| C. | X、Y、Z 分别与M元素形成的最简单化合物的沸点依次升高 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定含有离子键和共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com