
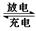 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)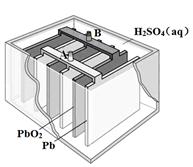
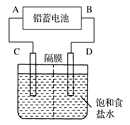
| A.放电时,正极反应为:PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l) |
| B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接 |
| C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接 |
| D.铅蓄电池做电源电解Na2SO4溶液时,当有2 mol O2产生时,消耗8 mol H2SO4 |
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.铝是负极,铝片上析出无色气体 |
| B.溶液中两电极间产生白色沉淀 |
| C.溶液中先产生白色沉淀,最后沉淀溶解 |
| D.石墨是正极,石墨棒上析出黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电池工作时,锂电极为阳极,发生还原反应 |
| B.电池充电时,Li+向阴极移动 |
| C.该电池的化学能可完全转化为电能 |
| D.新材料就是碳和硅化合而成的碳化硅材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
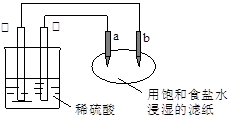
| A.a是正极,发生还原反应 |
| B.b是阳极,发生氧化反应 |
| C.稀硫酸中硫酸根离子的物质的量不变 |
| D.往滤纸上滴加酚酞试液,a极附近颜色变红 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铜锌稀硫酸原电池工作时,电子沿外电路从铜电极流向锌电极 |
| B.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e 4OH- 4OH- |
D.工业上电解饱和食盐水的阳极反麻:2Cl-- 2e C12↑ C12↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
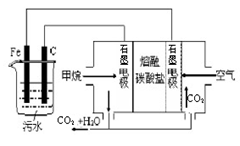
| A.铁电极为阳极,反应式为:Fe-3e-= Fe3+ |
| B.通入甲烷的石墨电极作负极,反应式为:CH4+8OH--8e-=CO2+6H2O |
| C.为增强污水的导电能力,可向污水中加入适量乙醇 |
| D.若阴极产生了44.8L气体,则理论上消耗同条件下的甲烷为11.2L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
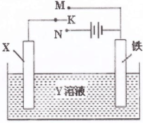
| A.X为碳棒,Y为NaCl溶液,开关K置于N处,溶液中阳离子移向碳棒 |
| B.X为锌棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,该法称为牺牲阳极的阴极保护法 |
| C.X为铜棒,Y为CuSO4溶液,开关K置于M处,铜棒质量将增加,外电路中的电子流向铜棒 |
| D.X为铜棒,Y为CuSO4溶液,开关K置于N处,铁棒质量将增加,溶液中Cu2+浓度不会改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
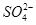 -2e-===PbSO4
-2e-===PbSO4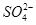 +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com