
分析 (1)非金属最弱的为溴,则溴的电负性最小,溴的最外层电子数为7;
(2)元素的非金属性越强,对应氢化物越稳定;
(3)二氯甲烷中,C没有孤对电子,形成4个共价单键;CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,则是由分子构成的物质,由相似相容可知,为非极性分子;
(4)冰晶石(Na3AlF6)晶体中,钠离子与阴离子以离子键结合,Al、F之间既有极性共价键,也有配位键;
(5)氰[(CN)2]的结构简式为N≡C-C≡N,三键中含2个π键,根据氯气与水溶液的反应,类推(CN)2与水的反应.
解答 解:(1)非金属最弱的为溴,则溴的电负性最小,溴的最外层电子数为7,所以溴的基态原子的价电子排布式是5s25p5,故答案为:5s25p5;
(2)同主族自上而下非金属性减弱,所以F、Cl、Br对应的氢化物稳定性由强到弱,即HF>HCl>HBr,故答案为:HF>HCl>HBr;
(3)二氯甲烷中,C没有孤对电子,形成4个共价单键,则C原子的杂化方式为sp3;CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,则是由分子构成的物质,由相似相容可知,为非极性分子,
故答案为:sp3;非极性;
(4)冰晶石(Na3AlF6)晶体中,钠离子与阴离子以离子键结合,Al、F之间既有极性共价键,也有配位键,所以冰晶石(Na3AlF6)晶体中存在离子键、极性键、配位键,
故答案为:ABC;
(5)氰[(CN)2]的结构简式为N≡C-C≡N,三键中含2个π键,所以共有2×2=4个π键,由Cl2+H2O=HCl+HClO可知,(CN)2的化学性质和卤素很相似,则(CN)2与水反应的化学方程式为(CN)2+H2O=HCN+HCNO,
故答案为:4;(CN)2+H2O=HCN+HCNO.
点评 本题以卤族元素考查原子的电子排布、氢键、分子极性及化学键等,侧重原子结构与性质的考查,注意(4)中化学键为解答的难点,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:解答题
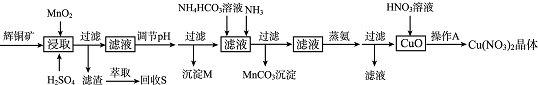
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19:8:13 | B. | 22:1:14 | C. | 13:9:29 | D. | 26:16:27 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H6 | B. | CH3CHO | C. | CH3COOH | D. | CH2=CH-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
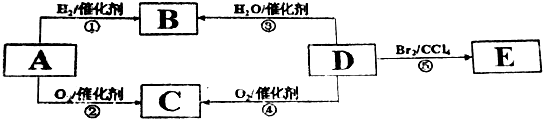
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
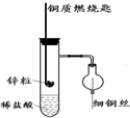 如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.
如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一电离能 | 电负性 | 稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
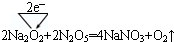 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com