
| A.2.7g | B.3.6g | C.5.4g | D.1.8g |
| 6 |
| 3 |
| 0.3mol |
| x |
| 2 |
| 3 |
| y |
| 0.3mol |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:不详 题型:单选题
| A.火焰温度太低不能使铝燃烧 | B.铝在空气中能很快形成氧化膜 |
| C.氧化铝的熔点比铝的熔点高 | D.用酸处理时未能将氧化铝溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Al→Al2O3→Al(OH)3→NaAlO2 |
| B.Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
| C.S→SO3→H2SO4→MgSO4 |
| D.Si→SiO2→H2SiO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.②⑤⑥⑦ | C.①③⑤⑦ | D.②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
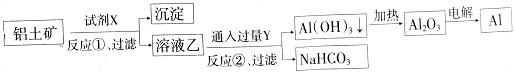
| A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
| B.反应①、过滤后所得沉淀为Fe2O3 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.试剂X可以是氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
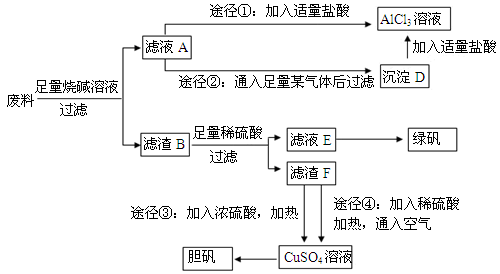
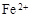 和
和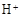 外,还可能存在 (用元素符号表示)。
外,还可能存在 (用元素符号表示)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
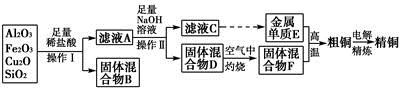
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com