
| A. |  | B. |  | C. |  | D. |  |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | HCHO | B. | CH3CHO | C. | C5H17CHO | D. | C6H5CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L稀硫酸100mL中含有硫酸根个数为0.1NA | |
| B. | 200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为NA | |
| C. | 2.4g金属镁与足量的盐酸反应,转移电子数为2 NA | |
| D. | 标准情况下,22.4LCl2和HCl的混合气体中含分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
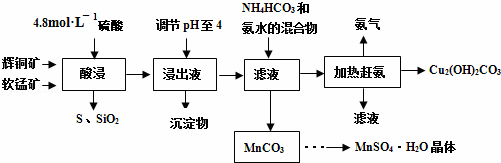
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
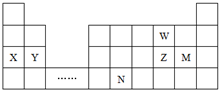
| A. | 原子半径:Y>Z>W | |
| B. | 单质的还原性:X>Y | |
| C. | 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室里易燃试剂与强氧化性试剂应分开放置并远离火源 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 滴定实验中所用到的滴定管和移液管,在使用前均需干燥或用相应的溶液润洗,容量瓶、锥形瓶则不应润洗 | |
| D. | 将含有少量氯化钾的硝酸钾放入烧杯中,加水溶解并加热、搅拌,当溶液表面出现一层晶膜时停止加热,冷却结晶,过滤即可得到大量硝酸钾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-a mol/L,若a>7,则pH一定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com