
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 5.2 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
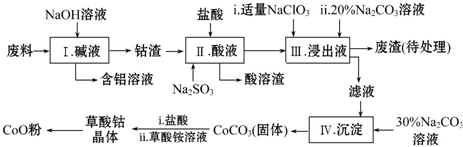
分析 废料中含有Al、Li、Co2O3和Fe2O3等物质,废料加入氢氧化钠溶液碱浸,得到钴渣为Li、Co2O3和Fe2O3等物质,加入盐酸溶解后发生氧化还原反应,氧化钴氧化氯离子为氯气,过滤得到酸溶的溶液加入碳酸钠溶液和NaClO3溶液净化,除去锂离子和铁离子,在滤液中加入碳酸钠溶液沉淀钴离子为碳酸钴沉淀,加入盐酸和草酸铵溶液得到草酸钴晶体,高温分解得到氧化钴,
(1)步骤Ⅰ中得到含铝溶液是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)步骤Ⅱ中Co2O3与Na2SO3在酸性溶液中发生氧化还原反应,生成二价钴离子,亚硫酸钠被氧化为硫酸钠;
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,是氯离子和ClO3-在酸溶液中发生氧化还原反应生成氯气,结合原子守恒和电子守恒分析配平书写离子方程式,依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子;
(4)固体加热在坩埚中进行,计算晶体物质的量n=$\frac{5.49g}{183g/mol}$=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150~210固体质量变化=5.49g=4.41g=1.08g,说明210°C失去结晶水得到CoC2O4,210~290℃过程中是CoC2O4发生的反应,210~290℃过程中产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明不是分解反应,参加费用的还有氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=$\frac{0.64g}{32g/mol}$=0.02mol,依据原子守恒配平书写反应的化学方程式;
(5)依据洗涤固体的方法同过滤的操作.
解答 解:(1)步骤Ⅰ中得到含铝溶液是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,所以溶液中的溶质为NaAlO2,
故答案为:NaAlO2;
(2)步骤Ⅱ中Co2O3与Na2SO3在酸性溶液中发生氧化还原反应,生成二价钴离子,亚硫酸钠被氧化为硫酸钠,反应离子方程式为Co2O3+SO32-+4H+=Co2++SO42-+2H2O,
故答案为:Co2O3+SO32-+4H+=Co2++SO42-+2H2O;
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,是氯离子和ClO3-在酸溶液中发生氧化还原反应生成氯气,ClO3-中氯元素化合价+5价降低为0价.氯元素化合价-1价变化为0价,反应的离子方程式:ClO3-+6H++5Cl-=3Cl2↑+3H2O,所以生成的有毒气体是Cl2,依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,所以碳酸钠的主要作用是沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,
故答案为:Cl2;调节溶液PH使铁离子沉淀完全转化为Fe(OH)3;
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,计算晶体物质的量n=$\frac{5.49g}{183g/mol}$=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150~210固体质量变化=5.49g=4.41g=1.08g,说明210°C失去结晶水得到CoC2O4,210~290℃过程中是CoC2O4发生的反应,产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明说明有气体参加反应应为氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=$\frac{0.64g}{32g/mol}$=0.02mol;n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,依据原子守恒配平书写反应的化学方程式为3CoC2O4+2O2 $\frac{\underline{\;210℃-290℃\;}}{\;}$Co3O4+6CO2,
故答案为:坩埚;3CoC2O4+2O2 $\frac{\underline{\;210℃-290℃\;}}{\;}$Co3O4+6CO2;
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,洗涤方法是在漏斗中加水没过沉淀,让水自行留下,重复2~3次,
故答案为:在漏斗中加水没过沉淀,让水自行留下,重复2~3次.
点评 本题考查了物质分离和提纯的方法,实验过程和物质性质的判断,离子方程式、化学方程式书写方法,化学式的计算分析应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 物质的量就是物质的质量 | |
| B. | 摩尔是国际单位制中七个基本物理量之一 | |
| C. | 物质的量是量度物质所含微粒多少的一个物理量 | |
| D. | 1mol任何物质都含有6.02×1023个微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+、Mg2+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液::K+、Al3+、Cl-、NO3- | |
| C. | 含有0.1mol•L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 无色透明的酸性溶液中:MnO4-、K+、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把浑浊的液体倒入蒸发皿内加热 | |
| B. | 开始析出晶体后用玻璃棒搅拌 | |
| C. | 加入试剂的顺序为Na2CO3、BaCl2、NaOH、HCl | |
| D. | 用过滤法除去粗盐中的泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
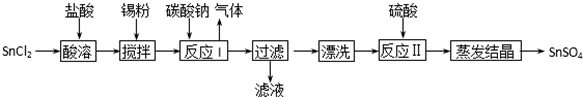
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧热是101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量 | |
| B. | 工业上用点燃H2、Cl2混合气体的方法生产盐酸 | |
| C. | 金属钠着火时可用干燥的沙土来灭火 | |
| D. | 驰名世界的中国瓷器是硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
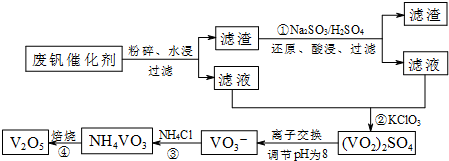
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 试剂A可以是稀硫酸或盐酸 | |
| B. | 加入试剂B除去Mg2+、Fe3+ | |
| C. | 滤渣1的主要成分是SiO2 | |
| D. | 电解氧化铝时在阴极上定期补充炭块 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com