
【题目】(1)对于下列反应:2SO2+O2![]() 2SO3, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)=0.5mol/(L·min),那么2min末SO2的浓度为 。
2SO3, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)=0.5mol/(L·min),那么2min末SO2的浓度为 。
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3 H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;将增大压强时反应速率变化情况画在c—d处。
2SO3 H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;将增大压强时反应速率变化情况画在c—d处。

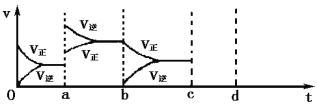
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,上图右表示酶参加的反应中温度与反应速率的关系,解释曲线变化原因 。
【答案】(1)2 mol/(L·min) 1 mol/(L·min) 2mol/L
(2)升高温度;减小SO3的浓度(示意图如下)

(3)温度低时,酶具有催化作用,随温度的升高反应速率加快;较高温度时,酶因受热变性而失去催化作用,故速率反而降低。
【解析】
试题分析:(1)用SO2浓度变化来表示的化学反应速率为v=![]() =
=![]() =2mol/(Lmin),v(O2)=
=2mol/(Lmin),v(O2)=![]() v(SO2)=1mol/(Lmin),同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以二氧化硫的反应速率是氧气的2倍为1mol/(Lmin),2min内二氧化硫浓度的变化量为1mol/(Lmin)×2min=2mol/L,则二氧化硫的平衡浓度=4mol/L-2mol/L=2mol/L;
v(SO2)=1mol/(Lmin),同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以二氧化硫的反应速率是氧气的2倍为1mol/(Lmin),2min内二氧化硫浓度的变化量为1mol/(Lmin)×2min=2mol/L,则二氧化硫的平衡浓度=4mol/L-2mol/L=2mol/L;
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率。
(3)温度低时,酶具有催化作用,随温度的升高反应速率加快;较高温度时,酶因受热变性而失去催化作用,故速率反而降低。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A. 胆矾、石膏、漂白粉都是纯净物
B. 氢氧化钙、HCl溶液、硫酸铜均为强电解质
C. 氯化钙、烧碱、聚苯乙烯均为化合物
D. 稀豆浆、鸡蛋清溶液、雾均为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分.

(1)写出元素符号: A________、F________。
(2)根据A~H元素在周期表中的位置,选适当的化学式或方程式填入空白处。
①单质中氧化性最强的是________,还原性最强的是________。
②最高价氧化物对应水化物碱性最强的是________,气态氢化物水溶液酸性最强的是_______。
③写出C的单质与B的最高价氧化物水化物溶液反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B、C、D四种物质混合放入VL密闭容器中,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了0.5nmol,C增加了1.5n mol,D增加了n mol。此时反应达到平衡。
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了0.5nmol,C增加了1.5n mol,D增加了n mol。此时反应达到平衡。
(1)以B的浓度变化表示的该反应的速率为v (B)= 。
(2)该化学方程式中,各物质的化学计量数分别为:a b c d
(3)若只改变压强,反应速率变化但平衡状态不移动,则各物质的聚集状态分别是:A B D 。若在上述平衡混合物中再加入B物质,上述平衡
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.条件不够,无法判断
(4)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为 反应。(填“放热”或“吸热”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍。请回答下列问题:
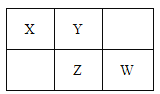
(1)元素Z位于周期表中的位置_____________。
(2)在标准状况下,用充满X元素的氢化物气体及少量空气的混合气体的烧瓶做喷泉实验,实验结束后,则烧瓶中所得溶液的物质的量浓度为____________mol/L(结果保留两位有效数字)。
(3)W、Z的最高价氧化物对应的水化物的酸性大小顺序____________(用化学式表示)。
(4)将W的单质通入含等物质的量FeBr2的溶液中,发生反应的离子方程式为
_______________________________________。
(5)Z和X形成的一种化合物相对分子质量在170~190之间,且Z的质量分数约为70%。该化合物的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构。下列叙述正确的是 ( )
A. 该物质有很高的熔点、很大的硬度 B. 该物质形成的晶体属于分子晶体
C. 该物质分子中Si60被包裹在C60里面 D. 该物质的相对分子质量为1200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已准确称量过的氯化钠固体配制1.00 mol·L-1的氯化钠溶液0.5 L,要用到的仪器是( )
①500 mL容量瓶 ②试管 ③烧瓶 ④胶头滴管 ⑤烧杯
⑥玻璃棒 ⑦托盘天平 ⑧药匙
A.①④⑤⑥
B.①②④⑤
C.①④⑤⑥⑦⑧
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种有机物的结构简式如下图,关于它的性质不正确的说法是( )
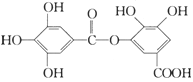
A.它有酸性,1 mol该物质最多能与6 mol H2发生加成反应
B.它可以水解,水解产物为两种有机物
C.在一定条件下,1 mol该物质最多能和8 mol NaOH反应
D.该有机物能发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com