
| A. | n+1 | B. | n-5 | C. | n+3 | D. | n+6 |
分析 X和Y可形成化合物根据化合物X2Y3,则X元素的化合价为+3价,Y元素的化合价为-2价,则X可能为B或Al元素,Y可能为O或S元素,还存在特殊情况为X为N元素,Y为O元素形成的化合物,据此进行解答.
解答 解:A.若化合物X2Y3为N2O3,N的核电荷数为7,O的为8,已知X的核电荷数为n,则Y的核电荷数为n+1,故A有可能;
B.若化合物X2Y3为Al2O3,Al的核电荷数为13,O的为8,已知X的核电荷数为n,则Y的核电荷数为n-5,故B有可能;
C.若化合物X2Y3为Al2S3,Al的核电荷数为13,S的为16,已知X的核电荷数为n,则Y的核电荷数为n+3,故C有可能;
D.根据价序原则,化合价为奇数的,核电荷数为奇数,化合价为偶数的,核电荷数为偶数,则X、Y的核电荷数之差不可能为偶数6,因奇数和偶数的差与和还是奇数,不可能为n+6,故D不可能;
根据分析可知,不可能的为D,
故选D.
点评 本题考查学生利用化合价与化学式及核电荷数的关系,题目难度中等,注意掌握常见的化合物中的元素的化合价及元素的核电荷数,能利用举例的方法或价序原则分析解答,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 热稳定性由高到低:NH3>PH3 | B. | 晶体熔点由高到低:SiC14>SiO2 | ||
| C. | 酸性由强到弱:HC1O4>HC1O | D. | 晶体熔点由高到低:MgO>MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| B. | 铝表面有一层致密的氧化膜,故铝制容器可以用来腌制咸菜等 | |
| C. | “埃博拉”病毒在常温下较稳定,对热有中度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| D. | 有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是:CH3C≡CH+CO+CH3OH$\stackrel{pd}{→}$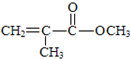 ,其过程符合绿色化学要求 ,其过程符合绿色化学要求 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol | B. | 0.4 mol | C. | 0.8 mol | D. | 0.45mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com