
(12分)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
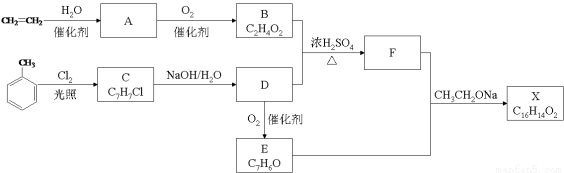
已知:RCHO+CH3COOR’ 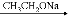 RCH=CHCOOR’ 请回答:
RCH=CHCOOR’ 请回答:
(1)A中官能团的名称是 ;C→D的反应类型为 。
(2)B+D→F的化学方程式 。
(3)E的结构简式 。
(4)对于化合物X,下列说法正确的是 。
A.能发生水解反应 B.能发生银镜反应
C.不与浓硝酸发生取代反应 D.能使Br2的CCl4溶液褪色
(5)F有多种同分异构体,含有酯基和一取代苯结构的同分异构体有五个,其中四个的结构简式是
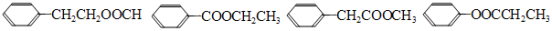
请写出另外一个同分异构体的结构简式 。
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:2016届贵州省贵阳市高三8月摸底考试化学试卷(解析版) 题型:填空题
(14分)水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(l)水的净化是用混凝剂将水中的胶体和悬浮物沉淀下来,而水的软化则是 ;
(2)生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是 ;
(3)下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是 (填字母);
A.福尔马林 B.漂白粉 C.氯气 D.臭氧
(4)Na2FeO4是一种新型水处理剂,工业上可用FeSO4制备Na2FeO4,其工艺流程如下:
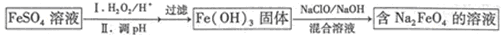
①硫酸亚铁常用作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾。用离子方程式解释这一原因: ;
②写出由Fe(OH)3制取Na2FeO4的化学方程式: ;
(5)石灰纯碱法是常用的硬水软化方法,已知25℃时Ksp(CaCO3)=2.8×10-9,现将等体积的Ca(OH)2溶液与Na2 CO3溶液混合(假设溶液体积具有加和性),若Na2 CO3溶液的浓度为5.6 x10一5mol·L一1,则生成沉淀所需Ca(OH)2溶液的最小浓度为 。
查看答案和解析>>
科目:高中化学 来源:2016届广西桂林市高三第一次月考化学试卷(解析版) 题型:选择题
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是
A、0.01 mol·L-1的蔗糖溶液 B、0.01 mol·L-1的CaCl2溶液
C、0.02 mol·L-1的NaCl溶液 D、0.02 mol·L-1的CH3COOH溶液
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期开学考试化学试卷(解析版) 题型:选择题
25℃时,向10 mL 0.1 mol·L-1 CH3COONa溶液中加入0.1 mol·L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示。下列说法正确的是
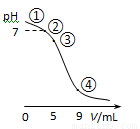
A.点①所示溶液中:c(OH-)=c(H+)+c(CH3COOH)
B.点②所示溶液中:c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1
C.点③所示溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
D.点④所示溶液中:c(Na+)+c(H+)<c(CH3COO-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省平凉市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
与氨碱法比较,下列关于联合制碱法优点的判断中不正确的是
A.提高了原料的原子利用率
B.降低了生产成本
C.减少了环境污染
D.减轻了对设备的腐蚀
查看答案和解析>>
科目:高中化学 来源:2016届山东省枣庄市高三9月阶段性学情检测化学试卷(解析版) 题型:选择题
现有十种物质:①水;②石墨;③氯气;④硫酸钡晶体;⑤醋酸;⑥二氧化碳;⑦氨水;⑧ 氯化钠固体;⑨熔化的氯化钠;⑩氯化钠溶液。请用序号按要求填空:
(1)其中能导电的是________
(2)属于强电解质的是______ 属于弱电解质的是________
(3)属于非电解质的是______
(4)既不是电解质也不是非电解质的是__________ 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省新高三开学初模拟检测化学试卷(解析版) 题型:选择题
下图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是

A.Janusene的分子式为C30H20
B.Janusene属于苯的同系物
C.Janusene苯环上的一氯代物有8种
D.Janusene既可发生氧化反应,又可发生还原反应
查看答案和解析>>
科目:高中化学 来源:2016届江汉油田海南海政学校高三月考化学试卷(解析版) 题型:选择题
在溶液中加入足量的Na2O2后仍能大量共存的离子组是
A.Na+、Fe2+、Cl-、SO42- B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期开学考试化学试卷(解析版) 题型:填空题
(共14分)SO2的含量是空气质量日报中一项重要检测指标,请结合所学知识回答下列问题。

(1)工业制硫酸过程中,SO2催化氧化的原理为:2SO2(g)+O2(g) 2SO3(g) 。T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO3(g) 。T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图所示。
①a、b两点对应的平衡常数K(a) K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a) c(b)。
②c点时,反应速率v(正) v(逆)。
(2)电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如下图所示(电极均为惰性材料):

①M极发生的电极反应式为 。
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e-所带电量为1.6×10-19C)。
(3)溶液法处理SO2。已知常温下H2SO3和H2CO3的电离常数如下表所示:

常温下,将SO2缓慢通入100mL 0.2mol•L-1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为 ;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com