
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环。下列说法不正确的是
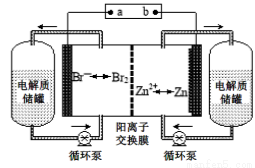
A.阳离子交换膜可阻止Br2与Zn直接发生反应
B.放电时负极的电极反应式为Zn-2e-=Zn2+
C.充电时电极a连接电源的负极
D.放电时左侧电解质储罐中的离子总浓度增大
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:2014-2015甘肃省白银市高二上学期期末化学试卷(解析版) 题型:填空题
(16分)Ⅰ.用中和滴定法测定某烧碱样品的纯度。(锥形瓶中装待测液)配制待测液:将2.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制200mL溶液。
(1)滴定:盛装0.20mol/L盐酸标准液应该用酸式滴定管;滴定时,先向盛待测液的锥形瓶中加酚酞作为指示剂;滴定终点的现象是:_____________________________
(2)有关数据记录如下:
滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.55 |
2 | 20.00 | 6.00 | 25.95 |
纯度计算:烧碱样品的纯度为________________。
(3)对几种假定情况的讨论:(填无影响、偏高、偏低)(测定的结果指烧碱溶液的浓度)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果___________________
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,则会使测定结果__________
③滴加盐酸时未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果________。
Ⅱ.现有室温下浓度均为1×10-3 mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④NaOH溶液,回答下列问题:
(1)将③、④混合后,若溶液呈中性,则消耗两溶液的体积为③________④(填“>”、“<”或“=”)。溶液中的离子浓度由大到小的顺序为________________。
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为___________,(填序号)最终产生H2总量的关系为___________(填序号)
(3)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①_________③(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省天一高三上学期大联考化学试卷(解析版) 题型:填空题
(选考)化学·选修5:有机化学基础(15分)非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:

请回答下列问题:
(1)非诺洛芬中的含氧官能团除了醚键外还有________(填名称)。
(2)反应④的反应类型为________。
(3)写出下列物质的结构简式:X________;C________.
(4)非诺洛芬的一种同分异构体满足下列条件:
①能发生银镜反应
②本身不能与FeCl3溶液发生显色反应,但水解产物之一可以发生显色反应
③分子中有6种不同化学环境的氢,且分子中含有两个苯环
任写一种符合以上条件的同分异构体的结构简式:______________.

反应①、③中还需的试剂分别为________、_________反应②的化学方程式为______ _____。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省天一高三上学期大联考化学试卷(解析版) 题型:选择题
用表示阿伏加德罗常数的值。下列叙述中不正确的是
A.16.9 g过氧化钡(BaO2)加入足量H2O中转移电子数目为0.1NA
B.常温常压下,28 g乙烯含有的电子数为16 NA
C.标准状况下,ag某气体含分子数为b,则cg该气体的体积为22.4bc/ NA a L
D.1 mol丙烷分子中含有的共用电子对数为8 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:填空题
(10分)工业上利用电解污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
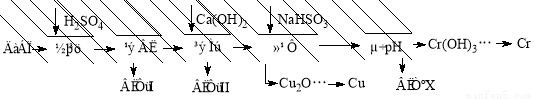
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有 。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH范围为: ~ ;②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:选择题
已知某温度下,Ksp(AgCl)=1.56×10-10 mol2·L-2,Ksp(Ag2CrO4)=1.12×10-12 mol3·L-3,下列叙述正确的是
A.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
B.向2.0×10-4 mol·L-1的K2CrO4溶液中加入等体积的2.0×10-4 mol·L-1 AgNO3 溶液,则有Ag2CrO4沉淀生成
C.将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大
D.将0.001 mol·L-1的AgNO3 溶液逐滴滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4的混合溶液中,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同
C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀
D.过量的铜与浓硝酸反应,生成的气体只有NO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:实验题
(12分)某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。

(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
FeCl3溶液显酸性的原因是_________。写出装置A中产生SO2的化学方程式:_________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:_____________________。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:______________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为_______________。
(4)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III._________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:选择题
有关下列离子方程式的说法正确的是
A.等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+=Mg(OH)2↓+H2O
B.向NaAlO2溶液中通入过量CO2的反应为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
C.等物质的量的FeBr2与Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com