
| A、做H2还原CuO的实验时,为防止H2爆炸,实验完毕,应先停止通H2,再停止加热 | ||
| B、配制稀硫酸溶液时,先在量筒加入一定体积的水,再沿容器壁慢慢加入浓硫酸,并不断搅拌 | ||
C、用试管夹从试管底由下往上夹住距离管口约
| ||
| D、分液漏斗在使用前要检漏,使用过程中要适当旋开活塞放气 |
| 1 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
| A、升高温度时H+浓度增大 |
| B、加水稀释时平衡向右移动 |
| C、加入少量NaOH时溶液pH减小 |
| D、溶液中水电离出的H+浓度等于OH-浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2个 | B、3个 | C、4个 | D、5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除④、⑦外 | B、除③、⑥外 |
| C、①②⑤ | D、除④外 |
查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
13 6 |
14 6 |
| A、①②④⑥ | B、①②④⑤ |
| C、①③④⑤ | D、②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“碘盐”应保存在阴凉处 |
| B、“碘盐”就是“I2+NaCl” |
| C、“碘盐”就是NaI |
| D、使用“碘盐”时宜高温煎炒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Q2=
| ||
B、Q2<
| ||
| C、Q2<Q1=Q | ||
| D、Q1=Q2<Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原溶液中的Br-可能未被氧化 |
| B、反应后的溶液中是否含有Fe2+可以用氯水和KSCN溶液检验 |
| C、取所得溶液加入CCl4后静置分液,向上层溶液中加入足量AgNO3 溶液,能产生黄色沉淀 |
| D、反应后的溶液中一定不存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
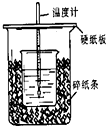 (1)用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com