
【题目】过硫酸钠(Na2S2O8)常用作漂白剂、氧化剂等。某研究小组利用下图装置制备Na2S2O8并探究其性质(加热及夹持仪器略去)。
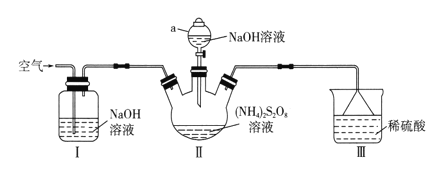
已知:①(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3+2H2O
Na2S2O8+2NH3+2H2O
②2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+N2+6H2O
6Na2SO4+N2+6H2O
(1)仪器a的名称是________________。装置I中NaOH溶液的作用是___________。
(2)装置II发生反应的同时,需要持续通入空气的目的是_______________________。
(3)装置III的作用是__________________________。
(4)Na2S2O8溶液与铜反应只生成两种盐,且反应先慢后快。
①该反应的化学方程式为___________________________。
②某同学推测反应先慢后快的原因可能是生成的Cu2+对反应起催化作用。设计实验方案验证该推测是否正确___________。(供选试剂:Cu、Na2S2O8溶液、CuSO4溶液、Cu(NO3)2溶液、蒸馏水)
(5)测定产品纯度:称取0.2500g样品,用蒸馏水溶解,加入过量KI,充分反应后,再滴加几滴指示剂,用0.1000mol/LNa2S2O8标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为19.50mL。(已知:I2+2S2O32-=S4O62-+2I-)
①选用的指示剂是____________;达到滴定终点的现象是______________________。
②样品的纯度为___________%。
【答案】分液漏斗 吸收空气中的CO2 将三颈烧瓶中产生的NH3及时排出,减少副反应的发生 吸收NH3,防止倒吸 Na2S2O8+Cu=Na2SO4+CuSO4 向盛有等质量铜粉的试管中,分别加入等体积的硫酸铜溶液和蒸馏水,再加入等体积等浓度的Na2S2O8溶液,若加入硫酸铜溶液的试管中反应快,则该推断正确 淀粉溶液 滴入最后一滴标准溶液,溶液的蓝色褪去,且半分钟内不复原 92.82
【解析】
(1)根据仪器结构判断其名称;NaOH溶液为碱溶液,可吸收空气中的CO2气体;
(2)NaOH溶液与(NH4)2S2O8反应会产生氨气,装置II发生反应的同时,需要持续通入空气可将装置中的NH3驱赶出来;
(3)装置III中稀硫酸溶液可以吸收NH3,由于使用了倒扣漏斗,故可以防止倒吸现象的发生;
(4)①过硫酸钠(Na2S2O8)具有强的氧化性,将Cu氧化为Cu2+,S2O82-被还原为SO42-,根据电子守恒、原子守恒分析;
②若设计一个实验证明Cu2+对反应起催化作用,可采取对比实验,其中一个没有Cu2+,另外一个有Cu2+可确定设想的合理性;
(5)①根据I2遇淀粉溶液变为蓝色,选用淀粉溶液为指示剂,根据KI与Na2S2O8发生反应生成I2,I2与Na2S2O3反应测定,若反应完全,溶液中无I2,蓝色消失分析判断;
②根据Na2S2O8发生反应生成I2及Na2S2O3的物质的量关系,用关系式法计算该样品的纯度。
(1)根据仪器结构可知该仪器名称为分液漏斗;装置I中NaOH溶液的作用是吸收空气中的CO2,防止干扰实验;
(2)在装置II中NaOH溶液与(NH4)2S2O8反应会产生氨气,为防止污染环境,在装置II发生反应的同时,需要持续通入空气可将装置中的NH3及时排出,减少副反应的发生;
(3)装置III是稀硫酸溶液,大量溶解吸收NH3,由于使用了倒扣漏斗,因此使气体被充分吸收,同时也可以防止倒吸现象的发生;
(4)①过硫酸钠(Na2S2O8)具有强的氧化性,能将Cu氧化为Cu2+,S2O82-被还原为SO42-,根据电子守恒、原子守恒可得反应的方程式为:Na2S2O8+Cu=Na2SO4+CuSO4;
②设计实验证明Cu2+对反应起催化作用的实验方法是:采取对比实验,向盛有等质量铜粉的试管中,分别加入等体积的硫酸铜溶液和蒸馏水,再加入等体积等浓度的Na2S2O8溶液,若加入硫酸铜溶液的试管中反应快,则该推断正确,否则Cu2+没有催化作用,推断错误;
(5)①根据I2遇淀粉溶液变为蓝色,可选用淀粉溶液为指示剂,若滴定达到终点,会看到溶液由蓝色变为无色,半分钟内不再变为蓝色判断;
②Na2S2O8作氧化剂,1mol会得到2mol电子,KI被氧化变为I2,转移2mol电子,I2与Na2S2O3反应方程式为:I2+2Na2S2O3=Na2S4O6+2NaI,可得关系式:Na2S2O8—I2—2Na2S2O3,n(Na2S2O3)= 0.1000mol/L×19.50mL×10-3L/mL=1.95×10-3mol,则n(Na2S2O8)=![]() n(Na2S2O3)=9.75×10-4mol,m(Na2S2O8)= 9.75×10-4mol×238g/mol=0.23205g,则该样品的纯度为(0.23205g ÷0.2500g)×100%=92.82%。
n(Na2S2O3)=9.75×10-4mol,m(Na2S2O8)= 9.75×10-4mol×238g/mol=0.23205g,则该样品的纯度为(0.23205g ÷0.2500g)×100%=92.82%。


科目:高中化学 来源: 题型:
【题目】美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如下图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。 “纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”的诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与金刚石互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类是由 __、____、 __ 三种元素组成的一类有机化合物,糖类又叫做__,原因是它们的化学组成大多数符合通式____。但不是所有的糖符合这个通式且符合这个通式的也不一定是糖。油脂的成分是________,由__组成,结构简式为________。维生素是参与生物 ___和 ______所必需的一类小分子有机化合物,它分为____维生素和____维生素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO![]() 和泥沙,可将粗盐溶于水,然后进行下列五项操作:
和泥沙,可将粗盐溶于水,然后进行下列五项操作:
①过滤 ②加过量NaOH溶液 ③加适量HCl ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
通过教材中“粗盐的提纯”及你做过的该实验回答下列问题:
(1)以上五步操作中,最后进行的是________。
(2)实验室进行NaCl溶液的蒸发时,一般有以下操作过程:
①固定铁圈位置 ②放置酒精灯 ③放上蒸发皿(蒸发皿中盛有NaCl溶液) ④加热搅拌 ⑤停止加热
正确的操作顺序为___________________。
(3)在粗盐经过一系列操作后的溶液中滴加过量饱和Na2CO3溶液。请问这步操作的目的是___________________________________________。判断Na2CO3溶液已经过量的方法是_________________________________________________________________。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:_________________________________________。
过滤时:_________________________________________。
蒸发时:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,见光易分解,在潮湿空气中易被氧化,难溶于水。
(1)实验室保存新制CuCl晶体的方法是_________________。
(2)已知:Cu(s)+Cl2(g)=CuCl2(s) △H1=-218.8kJ/mol
2Cu(s)+O2(g)=2CuO(s) △H2=-310.6kJ/mol
2CuCl2(s)=2CuCl(s)+Cl2(g) △H3=+152.3kJ/mol
则反应4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)的△H=____kJ/mol。
(3)利用CuCl难溶于水的性质,可以除去废水中的Cl-。向含Cl-的废水中同时加入Cu和CuSO4,溶液中平衡时相关离子浓度关系如图所示。[已知:pc(离子)=-lgc(离子)]

①除去废水中Cl-的离子方程式为_________________。
②Ksp(CuCl)=___________。
③已知:Cu+Cu2+![]() 2Cu+ K=7.6×10-7。通过计算说明上述除Cl-的反应能完全进行的原因______________________________。
2Cu+ K=7.6×10-7。通过计算说明上述除Cl-的反应能完全进行的原因______________________________。
(4)T℃时,用H2还原CuCl制备活性铜:H2(g)+2CuCl(s)![]() 2Cu(s)+2HCl(g),达到平衡时,H2的转化率(
2Cu(s)+2HCl(g),达到平衡时,H2的转化率(![]() )为80%。反应速率v=v正-v逆=
)为80%。反应速率v=v正-v逆=![]() ,k正、k逆分别为正、逆反应速率常数,x为气体的物质的量分数。当
,k正、k逆分别为正、逆反应速率常数,x为气体的物质的量分数。当![]() =60%时,
=60%时,![]() =________(保留1位小数)。
=________(保留1位小数)。
(5)CuCl溶于浓氨水的反应原理为CuCl+2NH3·H2O![]() [Cu(NH3)2]-+2H2O+Cl-,该反应控制温度为70~80℃,其原因是_______________________。
[Cu(NH3)2]-+2H2O+Cl-,该反应控制温度为70~80℃,其原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是:

A. 氧化物、化合物、纯净物
B. 碱性氧化物、金属氧化物、氧化物
C. 胶体、分散系、混合物
D. 复分解反应、置换反应、化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的有
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热。决定于生成物具有的总能量和反应物具有的总能量的大小
⑤热化学方程式应注明反应时的温度与压强,如没注明则表示常温常压时的反应
⑥等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑦H2(g)+I2(g) ![]() 2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
⑧同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照条件下和点燃条件下的ΔH相同
A. 2项 B. 3项 C. 4项 D. 5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料(主要为附在铝箔上的LiCoO2,还有少量铁的氧化物)中回收钴的一种工艺流程如下

请回答下列问题
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为_______。
(2)”溶液A中溶质除NaOH外,还有______。“钴渣”中LiCoO2溶解时的离子方程式为___________________________________。
(3)在“滤液”中加入20﹪Na2CO3溶液,目的是_________;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,原因是___________________________。
(4)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有_____________(任写一条)。
②工业生产中一般不用盐酸浸取“钴渣”,其原因是_____________________。
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热.使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com