
| A. | 1:2:3 | B. | 3:2:1 | C. | 9:3:1 | D. | 6:3:2 |
分析 根据消耗等物质的量的AgNO3,可知NaCl、MgCl2、AlCl3三种溶液中含氯离子的物质的量相同,根据化学式计算物质的量,进而计算物质的量浓度之比.
解答 解:解:分别加入足量的硝酸银溶液,Cl-沉淀完全时,消耗等物质的量的AgNO3,可知NaCl、MgCl2、AlCl3三种溶液中含氯离子的物质的量相同,
假设n(Cl-)=1mol,根据物质的化学式可知:
n(NaCl)=1mol,
n(MgCl2)=$\frac{1}{2}$mol,
n(AlCl3)=$\frac{1}{3}$mol,
溶液的体积相同,则物质的量之比等于物质的量浓度之比,
所以,三种溶液的物质的量浓度之比为:c(NaCl):c(MgCl2):c(AlCl3)=1:$\frac{1}{2}$:$\frac{1}{3}$=6:3:2,故选D.
点评 本题考查化学方程式有关计算,本题注意把握物质的量与体积、浓度等物理量的计算公式的运用,题目难度不大.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 各组成元素质量分数相同的烃是同一种烃 | |
| B. | 结构相似,组成上相差一个或若干个CH2原子团的有机物是同系物 | |
| C. | 能使溴的四氯化碳溶液褪色的烃一定是烯烃 | |
| D. | C3H6和C4H8不一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K CO2转化率% $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
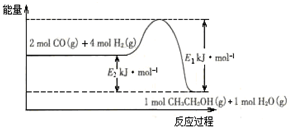
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com