
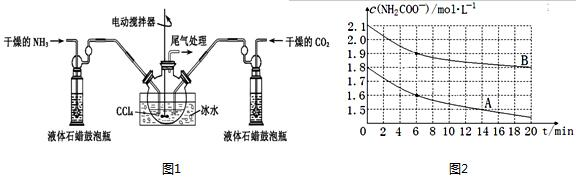
分析 (1)由题目信息可知,氨气与二氧化碳反应生成NH2COONH4;氨基甲酸胺易分解,图中反应装置用冰水冷却,防止氨基甲酸胺分解,说明制备氨基甲酸胺的为放热反应;
(2)根据液体石蜡瓶鼓泡瓶中气泡控制气体流速和原料气体的配比;
(3)由氨基甲酸胺小晶体悬浮在四氧化碳中,可以采取过滤方法分离;
(4)氨基甲酸胺极易水解,产物是碳酸氢铵和一种弱碱,该弱碱为NH3•H2O;水解反应为吸热反应,升高温度有利于水解进行,对比6~20min内c(NH2CCOO-)变化量越大,水解程度越大,温度越高;
(5)生成的沉淀为碳酸钡,根据碳原子守恒、混合物总质量列方程各自物质的量,再计算氨基甲酸胺的质量,进而计算其物质的量分数.
解答 解:(1)由题目信息可知,氨气与二氧化碳反应生成NH2COONH4,反应方程式为:2NH3(g)+CO2(g)?NH2COONH4,
氨基甲酸胺易分解,图中反应装置用冰水冷却,防止氨基甲酸胺分解,说明制备氨基甲酸胺的为放热反应,
故答案为:2NH3(g)+CO2(g)?NH2COONH4;放热;
(2)可以根据液体石蜡瓶鼓泡瓶中气泡,控制气体流速和调节NH3与CO2通入比例,
故答案为:通过观察气泡,控制气体流速和调节NH3与CO2通入比例;
(3)由氨基甲酸胺小晶体悬浮在四氧化碳中,可以采取过滤方法分离,
故答案为:过滤;
(4)氨基甲酸胺极易水解,产物是碳酸氢铵和一种弱碱,该弱碱为NH3•H2O,反应方程式为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O;
6~20min内曲线A中c(NH2CCOO-)减小量大于曲线B的,水解反应为吸热反应,升高温度有利于水解进行,故曲线A的温度高于曲线B的,
故答案为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O;A;6~20min内曲线A中c(NH2CCOO-)减小量大于曲线B的,水解反应为吸热反应,升高温度有利于水解进行;
(5)生成的沉淀为碳酸钡,其物质的量为:$\frac{11.82g}{197g/mol}$=0.06mol,
氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,
由碳元素守恒可知:x+y=0.06
由质量可得:78x+79y=4.69
解得x=0.05mol,y=0.01mol,
则制得的样品中氨基甲酸胺的物质的量分数为:$\frac{0.05mol}{0.06mol}$×100=83.3%,
故答案为:83.3%.
点评 本题考查物质制备实验、化学反应速率影响因素、物质含量测定、化学与技术等,题目难度中等,把握反应原理为解答的关键,侧重分析与实验能力的考查,综合性较强.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
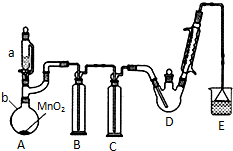 某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
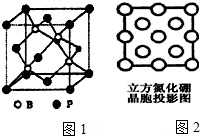 由N、B等元素组成的新型材料有着广泛用途.
由N、B等元素组成的新型材料有着广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| B. | 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) | |
| C. | 0.10mol•L-1 KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-) | |
| D. | 0.10mol•L-1Na2SO3溶液通入少量SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com