
| A. | 变化的化学方程式是:NaCl03+KCl=KClO3(结晶)+NaCl | |
| B. | KClO3是难溶物 | |
| C. | KClO3是比NaClO3更弱的电解质 | |
| D. | 相同温度下,KCl03的溶解度比NaCl03小 |
分析 若在NaClO3浓溶液中加入固体KCl,则可得到重要化工产品KClO3晶体,方程式为:NaCl03+KCl=KClO3(结晶)+NaCl,依据复分解反应的条件可知该反应能发生与Ca(ClO3)2、KClO3的溶解度有关,据此解答.
解答 解:相同温度下,KCl03的溶解度比NaCl03小,依据复分解反应的条件可知:NaCl03+KCl=KClO3(结晶)+NaCl能够发生,即在NaClO3浓溶液中加入固体KCl,则可得到重要化工产品KClO3晶体,而氯酸钾为钾盐,易溶于水,氯酸钾、氯酸钠都是可溶性盐,在水溶液中能够完全电离,都是强电解质,
故选:AD.
点评 本题考查了复分解反应条件,电解质、非电解质判断,明确反应原理及基本概念即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)<c(Cu2+)<c(H+)<c(SO42-) | B. | c(OH-)<c(H+)<c(SO42-)<c(Cu2+) | ||
| C. | c(OH-)<c(H+)<c(SO42-)=c(Cu2+) | D. | c(OH-)<c(H+)<c(Cu2+)<c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠、碳化钙着火时,可直接用高压水枪喷火扑灭 | |
| B. | 去除银器表面的Ag2S,可将银器放在盛有食醋的铝锅中煮沸 | |
| C. | 苹果在空气中久置变黄和纸张变黄的原理相似 | |
| D. | 用乙醚从黄花蒿中萃取青蒿素发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
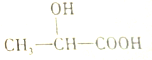
| A. | 1mol乳酸可以与足量的NaHCO3反应生成1molCO2 | |
| B. | 1mol乳酸可以与足量的钠反应生成1mol氢气 | |
| C. | 乳酸可以在一定条件下发生消去反应生成CH2=CHCOOH | |
| D. | 乳酸可以与NaOH溶液反应生成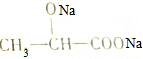 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
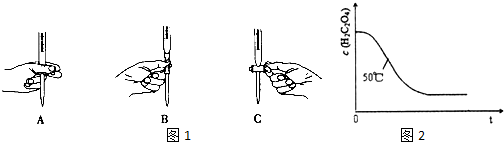
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响; b.实验1和3探究反应物浓度对该反应速率的影响; c.实验1和4探究催化剂对该反应速率的影响. | |
| 体积 (mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

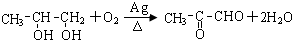 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com