
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
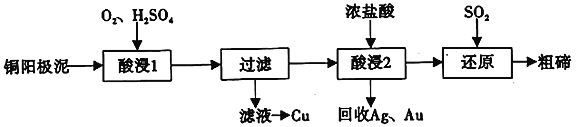
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为____________。
(2)“酸浸2”时温度过高会使Te的浸出率降低,原因是________________________。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为____________;
“还原”过程中,发生反应的离子方程式为_____________________________。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为____________________。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是_____________________。
(5)常温下,向l mol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=__________。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
【答案】Na2TeO3 温度升高,浓盐酸易挥发,反应物浓度减小,导致浸出率降低 Cu2Te + 2O2 + 2H2SO4 = 2CuSO4 + 2H2O + TeO2 2SO2 +Te4++4H2O = 2SO42-+ Te + 8H+ TeO32-+4e- + 3H2O = Te + 6OH- TeO32-在阳极直接被氧化,或阳极生成的氧气氧化TeO32-得到TeO42- 0.2
【解析】
(1)类比SO2与碱反应得出TeO2被浓NaOH溶液溶解所生成盐的化学式。
(2)分析温度升高,导致浓盐酸挥发,浓度减小,导致浸出率降低。
(3)根据流程图得出Cu2Te转化为TeO2反应的化学方程式,“还原”过程中,根据氧化还原反应得出离子方程式。
(4)电解过程实际是电解Na2TeO3溶液的过程,其阴极上发生还原反应,在阳极区可能TeO32-直接被氧化成TeO42-,或阳极生成的氧气氧化TeO32-得到TeO42-。
(5)将电离平衡常数两者相乘得出比值。
(1)TeO2被浓NaOH溶液溶解,根据SO2与碱反应得出所生成盐的化学式为Na2TeO3,故答案为:Na2TeO3。
(2)“酸浸2”时温度过高会使Te的浸出率降低,原因是温度升高,浓盐酸易挥发,反应物浓度减小,导致浸出率降低,故答案为:温度升高,浓盐酸易挥发,反应物浓度减小,导致浸出率降低。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2、Cu元素转化成CuSO4,反应的化学方程式为Cu2Te + 2O2 + 2H2SO4 = 2CuSO4 + 2H2O + TeO2;根据题给已知,TeO2溶于浓盐酸得到TeCl4,“还原”过程中二氧化硫将Te4+还原成Te,发生反应的离子方程式为2SO2 +Te4++4H2O = 2SO42-+ Te + 8H+,故答案为:Cu2Te + 2O2 + 2H2SO4 = 2CuSO4 + 2H2O + TeO2;2SO2 +Te4++4H2O = 2SO42-+ Te + 8H+。
(4)将铜阳极泥在空气中焙烧使碲转化为TeO2,TeO2用NaOH溶液浸取时转化为Na2TeO3,电解过程实际是电解Na2TeO3溶液的过程,其阴极上发生反应的电极方程式为TeO32-+4e- + 3H2O = Te + 6OH-,在阳极区溶液中检验出有TeO42-存在,TeO32-化合价升高变为TeO42-,生成TeO42-的原因是可能为TeO32-在阳极直接被氧化,也可能为阳极生成的氧气氧化TeO32-得到TeO42-,故答案为:TeO32-+4e- + 3H2O = Te + 6OH-;TeO32-在阳极直接被氧化,或阳极生成的氧气氧化TeO32-得到TeO42-。
(5)常温下,向l mol·L-1 Na2TeO3溶液中滴加盐酸,将![]() ,当溶液pH=5时,
,当溶液pH=5时,![]() ,故答案为:0.2。
,故答案为:0.2。


科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.高温条件下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应
B.实验室用![]() 与
与![]() 进行下列反应:
进行下列反应:![]()
![]()
![]() ;
;![]() ,当放出
,当放出![]() 热量时,
热量时,![]() 的转化率为
的转化率为![]()
C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进
D.等量的苛性钠溶液分别与pH为2和3的醋酸溶液恰好完全反应,设消耗醋酸溶液的体积依次为![]() 和
和![]() ,则
,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
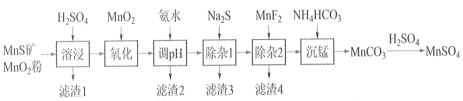
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的 pH 范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的 pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”中二氧化锰与硫化锰可以发生氧化还原反应,推测“滤渣1”含有___________ 和SiO2;
(2)“调pH”除铁和铝,溶液的pH范围应调节范围是________________之间。
(3)“除杂1”的目的是除去Zn2+和Ni2+,写出除Zn2+的方程式:__________________。
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高对沉淀Mg2+完全的影响是__________________(有利、不利、无影响)。
(5)在溶浸前,先把矿石研磨成粉末的原因:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是一种将化学能转化为电能的高效、环境友好的发电装置.该电池的构造如图所示,下列分析判断错误的是
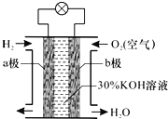
A.a极为负极,b极为正极
B.负极发生氧化反应
C.正极的电极反应为O2+2H2O+2e﹣═4OH﹣
D.负极的电极反应为H2+2OH﹣﹣2e﹣═2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(己知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
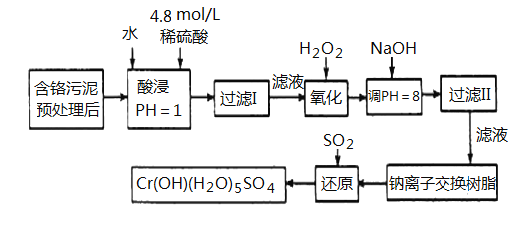
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | — | 一 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9 (>9溶解) |
(1)实验室用98% (密度为1.84 g·cm-3)的浓硫酸配制200mL4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL (保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需_____________________。
(2)在上述配制稀硫酸过程中,会导致所配溶液浓度偏大的操作是___________(填序号)
a. 转移溶液时,没有等溶液冷却至室温 b.量取浓硫酸时,俯视刻度线
c.当容量瓶中液体占容积2/3左右时,未振荡摇匀 d. 定容时俯视刻度线
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42- 或Cr2O72-),以便于与杂质离子分离;另一方面是_____________________________。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是___________________。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn +nNa+,被交换的杂质离子是________________。
(6)通SO2气体时,其化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:O2![]() MnO(OH)2
MnO(OH)2![]() I2
I2![]() S4O62-
S4O62-
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_______________________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 00 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示),写出计算过程_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为1L的密闭容器中充入1molCO2和3.25molH2,发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,测得CH3OH的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数K=2.25)下列说法正确的是
CH3OH(g)+H2O(g) △H<0,测得CH3OH的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数K=2.25)下列说法正确的是
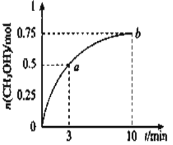
A.0-10min,v(H2)=0.075 mol/(L·min)
B.点 b 所对应的状态没有达到化学平衡状态
C.CH3OH 的生成速率,点 a 大于点 b
D.欲增大平衡状态时![]() ,可保持其他条件不变,升高温度
,可保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为___________________________。
(2)滤渣Ⅰ的主要成分是FeS2、S和________(填化学式);Fe3+被FeS2还原的离子方程式为_______________。
(3)“氧化”中,生成FeOOH的离子方程式为________________。
(4)滤液Ⅱ中溶质是Al2(SO4)3和________(填化学式):“洗涤”时,检验铁黄表面已洗涤干净的操作是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃的结构简式为:![]() ,有甲、乙、丙、丁四位同学分别将其命名为:2-甲基-4-乙基-4-戊烯;2-异丁基-1-丁烯;2,4-二甲基-3-己烯;4-甲基-2-乙基-1-戊烯,下面对4位同学的命名判断正确的是
,有甲、乙、丙、丁四位同学分别将其命名为:2-甲基-4-乙基-4-戊烯;2-异丁基-1-丁烯;2,4-二甲基-3-己烯;4-甲基-2-乙基-1-戊烯,下面对4位同学的命名判断正确的是
A. 甲的命名主链选择是错误的
B. 乙的命名对主链碳原子的编号是错误的
C. 丙的命名主链选择是正确的
D. 丁的命名是正确的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com