
| A. | 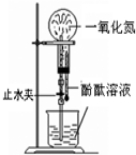 喷泉实验 | B. | 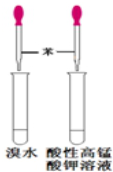 验证苯中是否含有碳碳双键 | ||
| C. | 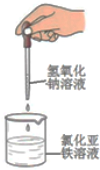 制备氢氧化亚铁 | D. | 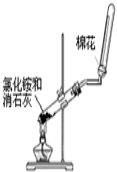 实验室制取并收集氨气 |
分析 A.一氧化氮气体不溶于水,无法形成喷泉实验;
B.碳碳双键不能与溴、酸性高锰酸钾溶液溶液反应;
C.氢氧化亚铁很容易被空气中氧气氧化,应该将胶头滴管的下端插入氯化亚铁溶液中;
D.加热固体,应防止试管炸裂.
解答 解:A.NO气体不与水反应,也难溶于水,无法形成压强差,则无法完成喷泉实验,故A错误;
B.苯中若含有碳碳双键,能够使溴水、酸性高锰酸钾溶液褪色,图示装置可验证苯中是否含有碳碳双键,故B正确;
C.氢氧化亚铁不稳定,易被氧气氧化而变质,制备氢氧化亚铁,应将胶头滴管插入液面以下,故C错误;
D.加热固体,试管口应略朝下倾斜,以防止试管炸裂,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及喷泉实验、氢氧化亚铁的制备、有机物的结构及气体的制备实验等知识,把握物质的性质、反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 某酸性溶液中只含有Na+.CH3COO-.H+.OH-,向该溶液中加入适量氨水,c(CH3COO-)一定大于c(Na+)与 c(NH4+)之和 | |
| B. | 常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液.溶液中n(CH3COO-)+n(OH-)-n(H+)=0.006mol | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)<c(NO3-) | |
| D. | 物质的量浓度相等的NaF和NaCN溶液中阴离子总数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | s电子云是球状,而p电子云是哑铃状 | |
| B. | 同一能层中,p能级上的电子比s能级上电子能量高 | |
| C. | 能量高的电子在离原子核较近的区域运动 | |
| D. | 各能级最多容纳电子数是该能级原子轨道数的两倍,其理论依据是泡利不相容原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2CO3 | K${\;}_{{\;}_{{a}_{1}}}$=4.3×10-7 | HClO | Ka=2.95×10-8 |
| K${\;}_{{a}_{2}}$=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
; 和a个-CH3,其余为-OH,则-OH 的个数为m+2-a
和a个-CH3,其余为-OH,则-OH 的个数为m+2-a查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com