
【题目】I、有A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量按A、B、C的顺序依次增大。将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、NH4+、SO![]() 、NO
、NO![]() 、Cl-五种离子,同时生成一种白色沉淀。请回答下列问题:
、Cl-五种离子,同时生成一种白色沉淀。请回答下列问题:
(1)经检验,三种盐中还含有下列选项中的一种离子,该离子是____________。
A. Na+ B.Ba2+ C.Mg2+ D. Cu2+
(2)写出C的化学式:C____________。
(3)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Fe3+、Cl-、NO![]() 、NH4+四种离子且物质的量之比依次为1∶1∶3∶1(不考虑水电离的影响)。则A、B、C三种盐的物质的量之比为____________。若向B溶液中通入少量SO2气体,有沉淀和无色气体产生,该沉淀为 。
、NH4+四种离子且物质的量之比依次为1∶1∶3∶1(不考虑水电离的影响)。则A、B、C三种盐的物质的量之比为____________。若向B溶液中通入少量SO2气体,有沉淀和无色气体产生,该沉淀为 。
II、已知某KNO3溶液A中,混有少量的Ca2+和SO![]() 等杂质,某同学设计了如下实验方案以制得纯净的KNO3固体。
等杂质,某同学设计了如下实验方案以制得纯净的KNO3固体。

根据上述回答:
(1)沉淀D中所含有的物质是 。
(2)按上述实验方案制得的KNO3晶体,经分析测定仍含有杂质,其原因是上述第 步(填① ② ③)可能有误,请加以改正: 。
【答案】I(1)B(2)Fe2(SO4)3
(3)2∶3∶1(2分)硫酸钡(或BaSO4)
II(1)BaCO3和CaCO3
(2)③ 向E溶液中加入适量的HNO3溶液,再蒸发结晶(2分)
【解析】
试题分析:I.等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、NH4+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀,A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大,则A为盐酸盐,B为硝酸银,C为硫酸盐;等物质的量混合,生成沉淀可能为BaSO4,则A为NH4Cl,B为Ba(NO3)2,C为Fe2(SO4)3 ,
(1)由上述分析可知,只有Ba2+与SO42-生成沉淀,故答案为B;
(2)由上述分析可知,A为NH4Cl,B为Ba(NO3)2,C为Fe2(SO4)3 ;
(3)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Fe3+、Cl-、NO![]() 、NH4+四种离子且物质的量之比依次为1∶1∶3∶1,令Fe3+、Cl-、NO
、NH4+四种离子且物质的量之比依次为1∶1∶3∶1,令Fe3+、Cl-、NO![]() 、NH4+四种离子的物质的量依次为1mol、1mol、3mol、1mol,同时SO42-和Ba2+恰好完全沉淀,则NH4Cl为1mol,Ba(NO3)2为1.5mol,Fe2(SO4)3为0.5mol,三者的物质的量之比为2∶3∶1;向Ba(NO3)2溶液里通入SO2,SO2在酸性条件下被NO3-氧化成SO42-,同时NO3-还原为NO,SO42-和Ba2+生成BaSO4沉淀。
、NH4+四种离子的物质的量依次为1mol、1mol、3mol、1mol,同时SO42-和Ba2+恰好完全沉淀,则NH4Cl为1mol,Ba(NO3)2为1.5mol,Fe2(SO4)3为0.5mol,三者的物质的量之比为2∶3∶1;向Ba(NO3)2溶液里通入SO2,SO2在酸性条件下被NO3-氧化成SO42-,同时NO3-还原为NO,SO42-和Ba2+生成BaSO4沉淀。
Ⅱ.溶液A中,混有少量的Ca2+和SO42-等杂质,由分离流程可知,加硝酸钡,与硫酸根离子反应,则沉淀B为BaSO4,溶液C中含KNO3及Ca2+、Ba2+,再加碳酸钾,反应生成的沉淀D为CaCO3、BaCO3,则溶液E中含KNO3及碳酸钾,应加硝酸后蒸发结晶得到硝酸钾晶体,
(1)由上述分析可知,沉淀D为CaCO3、BaCO3;
(2)第②步加入过量碳酸钾溶液,第③步需除去溶液里有多余CO32,否则E中含碳酸钾,具体操作是应加足量硝酸,再蒸发结晶。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】已知硒元素的核电荷数为34,下列关于80Se的说法正确的是( )
A. 80Se的核外有34个电子 B. 80Se的质量数是46
C. 80Se的核内有34个中子 D. 80Se的核内有80个质子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 2 mol/L H2SO4与过量Zn粉反应,在一定温度下,为了加快反应速率,但又不影响生成氢气的总量,可以采取的措施是( )
A. 加入碳酸钠固体
B. 改用18 mol/L的浓H2SO4
C. 滴入少量硫酸铜溶液
D. 加入硫酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在,钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面,锂混杂于其中。从废料中回收氧化钴(CoO)工艺流程如下:
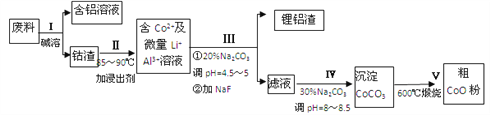
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为________
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为 (产物中只有一种酸根)_________________
在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用 盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因是____________________
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式__________________
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,能说明化学平衡一定向正反应方向移动的是
A、N2O4(g)![]() 2NO2(g),改变某一条件后,气体颜色加深
2NO2(g),改变某一条件后,气体颜色加深
B、H2(g)+I2(g)![]() 2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2
2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2
C、N2(g)+3H2(g)![]() 2NH3(g),改变某一条件后,NH3的体积分数增加
2NH3(g),改变某一条件后,NH3的体积分数增加
D、2SO2(g)+O2(g)![]() 2SO3(g),恒温恒压条件下,充入He
2SO3(g),恒温恒压条件下,充入He
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) △H> 0请回答下列问题
P(g)+Q(g) △H> 0请回答下列问题
(1)在某温度下,反应物的起始浓度分别为c(M)=1mol/L,c(N)=2.4mol/L;达到平衡后,M的转化率为60%,此时N的转化率为____________
(2)若反应温度升高,M的转化率 (填“增大”、“减小”或“不变”)
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol/L,c(N)=amol/L;达到平衡后,c(P)=2mol/L,a=____________
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=bmol/L,达到平衡后,M的转化率为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl、S、P为三种原子序数相连的元素,则下列说法正确的是( )
A. 气态氢化物的稳定性:HCl>H2S>PH3
B. 非金属活泼性:S<Cl<P
C. 原子半径:Cl>S>P
D. 原子序数:S<P<Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与盐类水解无关的是
A. 粗盐在空气中易潮解 B. NH4Cl与ZnCl2用于金属焊接中除锈
C. 用热纯碱溶液去油污 D. 蒸干并灼烧FeCl3溶液得到Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com