
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量;
(2)根据c=$\frac{n}{V}$计算盐酸的物质的量浓度;
(3)根据n=cV计算HCl的物质的量;
(4)含有原子数目相等,则含有原子物质的量相等,结合分子式中原子数目计算氨气物质的量,再根据m=nM计算氨气质量.
解答 解:(1)根据n=$\frac{V}{{V}_{m}}$可知,标况下44.8L HCl的物质的量为$\frac{44.8L}{22.4L/mol}$=2mol,
故答案为:n=$\frac{V}{{V}_{m}}$;2mol;
(2)溶于水,配成500mL的溶液,根据c=$\frac{n}{V}$可知,盐酸的物质的量浓度为$\frac{2mol}{0.5L}$=4mol/L,
故答案为:c=$\frac{n}{V}$;4mol/L;
(3)100mL该盐酸溶液中HCl的物质的量为0.1L×4mol/L=0.4mol,
故答案为:0.4mol;
(4)含有原子数目相等,则含有原子物质的量相等,故氨气物质的量为$\frac{2mol×2}{4}$=1mol,则氨气质量为1mol×17g/mol=17g,
故答案为:17.
点评 本题考查物质的量有关计算,明确计算公式即可解答,注意对基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L HCl时所得的盐酸浓度不是1 mol/L,只有当22.4 L HCl溶于水制得1 L盐酸时,其浓度才是1 mol/L | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,100 mL 0.35 mol/L的KCl饱和溶液蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
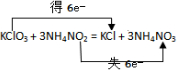 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向水中加入少量硫酸氢钠固体 | B. | 向水中加入少量硫酸铝固体 | ||
| C. | 向水中加入少量氯化铵固体 | D. | 将水加热到100℃,使水的pH=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电镀铜时,电解质溶液中铜离子浓度不断减小 | |
| B. | 电解精炼铜时,电解质溶液中铜离子浓度不变 | |
| C. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,会使反应速率减慢 | |
| D. | 要使电解后的CuSO4溶液复原,可向其中加人CuO固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
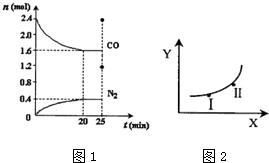
| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗和烧杯分离水和乙酸乙酯的混合物 | |
| B. | 用瓷坩埚熔融烧碱 | |
| C. | 用玻璃棒蘸少量待测物质的浓溶液做焰色反应 | |
| D. | 将pH试纸直接插入溶液中测量某溶液pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com