
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
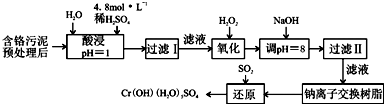
分析 含铬污泥酸浸后滤去不溶物,滤液中加入过氧化氢,由(2)可知过氧化氢将Cr3+氧化为Cr2O72-,此外将Fe2+氧化为Fe3+,再加入NaOH调节pH=4,使Fe3+转化为Fe(OH)3,过滤除去,滤液经过钠离子交换树脂后,被二氧化硫还原得到CrOH(H2O)5SO4,则钠离子交换膜除去溶液中Al3+、Ca2+、Mg2+.
(1)酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施;硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+和Mg2+,酸浸是溶解物质为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等;
(2)过氧化氢是氧化剂可以氧化亚铁离子为铁离子;
(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+、Cu2+转化为沉淀除去;
(4)钠离子交换树脂交换的离子是阳离子,为溶液中钙离子和镁离子;
(5)依据流程图中的转化关系和产物,结合二氧化硫的还原性,利用氧化还原反应原理分析书写,根据方程式计算或或电子守恒计算;
(6)①Fe为阳极,发生反应:Fe-2e-=Fe2+,得到还原性的Fe2+离子将还原Cr2O72-还原为Cr3+,阴极发生反应:2H++2e-=H2↑,溶液中氢离子浓度减小,溶液pH增大,Cr3+、Fe3+转化为Cr(OH)3和Fe(OH)3沉淀除去;
②根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)、Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)计算.
解答 解:含铬污泥酸浸后滤去不溶物,滤液中加入过氧化氢,由(2)可知过氧化氢将Cr3+氧化为Cr2O72-,此外将Fe2+氧化为Fe3+,再加入NaOH调节pH=4,使Fe3+转化为Fe(OH)3,过滤除去,滤液经过钠离子交换树脂后,被二氧化硫还原得到CrOH(H2O)5SO4,则钠离子交换膜除去溶液中Al3+、Ca2+、Mg2+.
(1)酸浸是溶解物质为了提高浸取率,可以将污泥粉碎、进行搅拌,以增大接触面积,可以延长浸取时间,可以升高温度,也可以过滤后再向滤渣中加入硫酸,进行多次浸取,合并浸取液,
故答案为:ABC;
(2)氧化过程中加入H2O2,除了能把Cr3+氧化为Cr2O72-外,另一个作用是氧化亚铁离子为铁离子,便于除去,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液PH=8,Fe3+、Cu2+、Al3+转化为沉淀除去,过滤Ⅱ得到的沉淀为Fe(OH)3、Al(OH)3、Cu(OH)2,
故答案为:Fe(OH)3、Al(OH)3、Cu(OH)2;
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是钙离子和镁离子,
故答案为:Ca2+,Mg2+;
(5)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成氢氧化钠溶液和硫酸反应生成硫酸钠,依据原子守恒分析书写配平;3SO2+2Na2CrO4+8H2O=2CrOH(H2O)3SO4↓+Na2SO4+2NaOH,每生成1molCr(OH)(H2O)3SO4,消耗SO2的物质的量1.5mol,或电子守恒计算,反应中Cr元素化合价由+6价降低为+3价,S元素由+4价升高为+6价,根据电子转移守恒,消耗SO2物的质量为$\frac{1mol(6-3)}{6-4}$=1.5mol,
故答案为:1.5mol;
(6)①Fe为阳极,发生反应:Fe-2e-=Fe2+,得到还原性的Fe2+离子将还原Cr2O72-还原为Cr3+,阴极发生反应:2H++2e-=H2↑,溶液中氢离子浓度减小,溶液pH增大,Cr3+、Fe3+转化为Cr(OH)3和Fe(OH)3沉淀除去,铁电极与直流电源正极相连,加入适量NaCl的目的是增大溶液导电能力,
故答案为:正极;增大溶液导电能力;
②Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.0×10-13×c3(OH-)=4.0×10-38,
而Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.0×10-31,
联立可得c(Cr3+)=3.0×10-6mol/L,
故答案为:3.0×10-6mol/L.
点评 本题以化学工艺流程为载体,考查物质分离提纯、对原理与操作的分析评价、信息获取与迁移运用、氧化还原反应计算、电解原理、溶度积有关计算等,题目综合性强,侧重考查学生分析解决问题的能力,是高考题的常见形式,关键是理解工艺流程,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | A元素与C元素形成的分子不可能是非极性分子 | |
| B. | A、C、D元素分别与氢元素形成的最简单氢化物中,D的氢化物沸点最高 | |
| C. | A、B、C、D四种元素的基态原子中,B的原子半径最大 | |
| D. | A、B、C、D 四种元素对应单质的晶体都是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | Na2O2 | C. | CuO | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
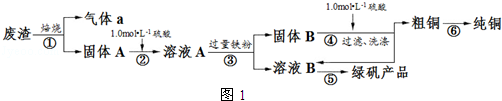
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.20 | 20.22 |
| 第二次 | 25.00 | 0.56 | 24.54 |
| 第三次 | 25.00 | 0.42 | 20.40 |
| A. | 0.0853mol/L | B. | 0.1000mol/L | C. | 0.0800mol/L | D. | 0.1250mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=1的稀硫酸中含有的H+数为0.1NA | |
| B. | 1mol苯分子中含有的碳碳双键数为3NA | |
| C. | 18gH2O中含有的质子数为10NA | |
| D. | 50mL12mol•L-1的盐酸与足量的MnO2共热,生成的Cl2分子数为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
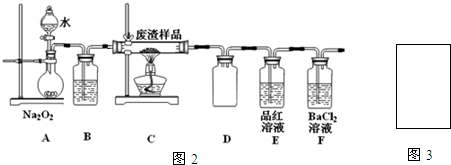
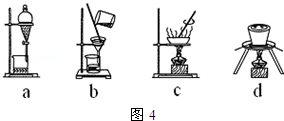
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 操作 | 从CCl4萃取溴水中溴后的混合液中分离 | 二氧化锰与浓盐酸反应制干燥氯气 | 可用于制备并观察氢氧化铁沉淀 | 检查装置气密性 |
| 实验装置 | 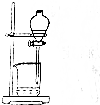 | 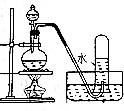 | 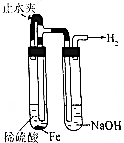 | 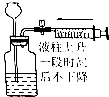 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com