
科目:高中化学 来源: 题型:
世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。下列有关叙述正确的是( )
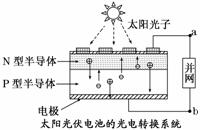
A.光伏电池是将太阳能转变为电能
B.光伏电池是将化学能转变为电能
C.电流从a流向b
D.图中N型半导体为正极,P型半导体为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是
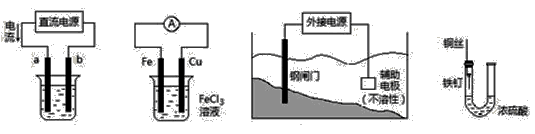
① ② ③ ④
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+= Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,10 mL0.1mol·L-1的氨水加水稀释后,下列说法正确的是
A.溶液的pH增大
B.溶液中NH4+和OH—离子的数目减少
C.NH3·H2O的电离程度增大,c(H+)也增大
D.加入适量盐酸使c(NH+4)=c(Cl—),混合液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1。
 (1)人的汗液中台有T的简单离子,其离子结构示意图为__________; 元素M在元素周期表中的位置是_____________。
(1)人的汗液中台有T的简单离子,其离子结构示意图为__________; 元素M在元素周期表中的位置是_____________。
(2)R的最高价氧化物所含的化学键类型是__________键(选填“离子”或“共价”)。
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为_________________________________(用具体的化学式表示)。
(4)在一定条件下甲、乙、丙有如下转化:甲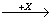 乙
乙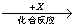 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________________(选填序号,下同)。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________________(选填序号,下同)。
①R ②Q2 ③M ④T2
(5)元素T的含氧酸HTO具有漂白性。往20mL 0.0lmol·L-l的HTO溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示。据此判断:该烧碱溶液的浓度为______________mol·L-l;下列有关说法正确的是_______________。
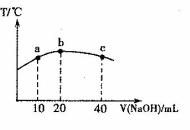 ①HTO的电离平衡常数:b点>a点
①HTO的电离平衡常数:b点>a点
②由水电离出的c(OH—):b点<c点
③从a点到b点,混合溶液中可能存在:
c(TO—)== c(Na+)
④从b点到c点,混合溶液中一直存在:
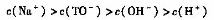
查看答案和解析>>
科目:高中化学 来源: 题型:
苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,榨汁时加入维生素C可有效防止这种现象发生,说明维生素C具有( )
A.氧化性 B.还原性 C.碱性 D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸钠和碳酸钠的混合物4.96 g中加入足量的4.80%的盐酸(密度为1.02 g/mL),充分反应后,在标准状况下收集到0.448 L二氧化碳。试求:
(1)混合物中碳酸钠的物质的量。
(2)混合物中硫酸钠的质量分数(保留两位小数)。
(3)盐酸的物质的量浓度(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下:

(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:________________________________________________________________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
A.铜粉 B.氨水
C.氢氧化铜 D.碱式碳酸铜
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=_____________________________________,
此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70 mL混合,反应的离子方程式为__________________________________________________________________。
(5)在0.1 L的混合酸溶液中,c(HNO3)=2 mol·L-1,c(H2SO4)=3 mol·L-1,将0.3 mol的铜放入加热充分反应后,被还原的HNO3的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com