
【题目】有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的相互分离。相应的实验过程可用如图表示:
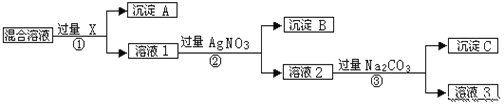
请回答下列问题:
①沉淀A的化学式:________
②过程③中加入过量的Na2CO3的目的是_______________
③按此实验方案得到的溶液3中比原溶液多了___________离子(填化学式),除去该离子的方法是_________
④为了尽可能完全分离三种离子,步骤①②③过滤后都需要洗涤,请描述洗涤操作_____________
【答案】BaSO4 除去过量的Ba(NO3)2和AgNO3 CO32- 加入稍过量的稀硝酸 往漏斗内加水浸没沉淀,待水自然流出后,重复以上操作2~3次
【解析】
①沉淀Cl-时,通常需加入Ag+,沉淀SO42-时,通常需加入Ba2+,若先加入Ag+,Cl-、SO42-都会转化为沉淀,所以应先加入Ba2+,让SO42-生成沉淀。
②因为沉淀Cl-、SO42-时,加入的除杂试剂都是过量的,过量的除杂试剂又成为杂质,需要再除去,所以过程③中加入过量的Na2CO3。
③加入了过量的Na2CO3,溶液中必然存在CO32-,要除去它,选择试剂时,需考虑不能引入杂质离子。
④因为沉淀都难溶于水,所以可用水洗涤。
①经过以上分析,确定先加入Ba(NO3)2,从而得出沉淀A的化学式BaSO4。答案为:BaSO4;
②因为除去Cl-、SO42-时,加入的除杂试剂都是过量的,所以过程③中加入过量的Na2CO3的目的是除去过量的Ba(NO3)2和AgNO3。答案为:除去过量的Ba(NO3)2和AgNO3;
③加入了过量的Na2CO3,溶液中必然存在CO32-,所以得到的溶液3中比原溶液多了CO32-,除去该离子的方法是加入稍过量的稀硝酸。答案为:CO32-;加入稍过量的稀硝酸;
④洗涤操作为:往漏斗内加水浸没沉淀,待水自然流出后,重复以上操作2~3次。答案为:往漏斗内加水浸没沉淀,待水自然流出后,重复以上操作2~3次。


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】FeCl3溶液常用于蚀刻电路板,蚀刻后的酸性溶液中含有Cu2+、Fe2+、Fe3+、Cl-等。下列各组离子能在该酸性溶液中大量共存的是( )
A.Na+、Al3+、Cl-、SO42-B.Ca2+、Mg2+、NO3-、ClO-
C.K+、NH![]() 、SO32-、AlO2-D.Ba2+、K+、I-、NO3-
、SO32-、AlO2-D.Ba2+、K+、I-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种。现做如下实验:
(1)取少量该溶液,滴入用硝酸酸化的AgNO3溶液,有白色沉淀生成。
(2)另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用右图表示。
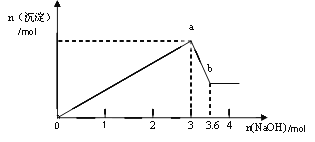
试推断:
(1)该溶液中以上离子一定存在的有___________,一定不存在的有____________。
(2)上述溶液中至少有_____________、(填化学式)等物质混合而成,其物质的量的比为_________。
(3)写出图中a![]() b变化过程的离子方程式_________________。
b变化过程的离子方程式_________________。
(4)为进一步确定溶液中其他的阳离子,应该补充的实验是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置闭合电键K时,电流计A的指针将发生偏转。试回答:
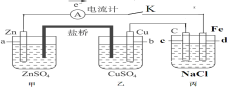
(1)丙池是___(填“原电池”或“电解池”)。
(2)乙中Cu极的电极反应是___,若电路中有0.02mol电子通过,则甲中a电极溶解的质量为___g。
(3)闭合电键K一段时间后,丙池中生成二种气体和一种碱,则丙池中发生的总的离子反应方程式是___。
(4)如果要给丙中铁片上镀上一层Ag,则丙池应作何改进___。
(5)丙池中反应进行较长时间后,收集到标准状况下氢气2.24L。此时测得丙池溶液质量实际减少4.23g,含有碱0.100mol(不考虑气体在水中的溶解),则实际放出气体的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂。20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键。
步骤:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH=+1493kJmol-1,ΔS=+61JK-1mol-1
该反应发生温度高达2170℃,能耗大,对设备和生产要求几乎达到苛刻程度。目前科学家采用金红石加碳氯化方法,在较温和条件下成功制取TiCl4,为人类快速迈进钛合金时代做出了巨大贡献。金红石加碳氯化的主要反应如下:
反应Ⅰ:TiO2(s)+2Cl2(g) +C(s)![]() TiCl4(g)+CO2(g) ΔH1,ΔS1=+64JK-1mol-1
TiCl4(g)+CO2(g) ΔH1,ΔS1=+64JK-1mol-1
反应Ⅱ:TiO2(s)+2Cl2(g) +2C(s)![]() TiCl4(g)+2CO(g) ΔH2,△S2
TiCl4(g)+2CO(g) ΔH2,△S2
已知:①C(s)+O2(g)=CO2(g) ΔH=-394.3kJmol-1
②2C(s)+O2(g)=2CO(g) ΔH=-222.3kJmol-1
请回答:
(1)反应Ⅰ的ΔH1=__kJmol-1。
(2)对于气体参加的反应,表示平衡常数KP时,用气体组分B的平衡压强P(B)代替该气体物质的量浓度c(B),则反应Ⅰ的KP=__(用表达式表示)。
(3)在常温、常压、光照条件下,N2在催化剂TiO2表面与H2O发生反应,2N2(g)+6H2O(1)=4NH3(g)+3O2(g) ΔH=+1530.4kJmol-1
进一步研究相同条件下NH3生成量与温度的关系,部分实验数据见表:
实验组别 | 1 | 2 | 3 | 4 |
T/K | 303 | 313 | 323 | 353 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
O2生成量/(10-6mol) | 3.6 | 4.4 | 4.5 | 1.5 |
反应时间/h | 3 | 3 | 3 | 3 |
容器体积/L | 2 | 2 | 2 | 2 |
①请在如图中画出上述反应在“有催化剂”与“无催化剂”两种情况下反应过程中体系能量随反应过程的变化趋势示意图(图中标明必要的文字说明)。___
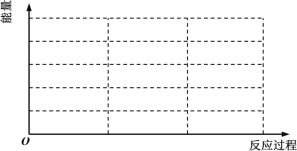
②根据表中数据,在303K时,在3h内用氮气表示其平均反应速率为___molL-1h-1。判断组别4中反应是否达到平衡状态___(填“是”或“否”),并说明理由___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钟南山院士指出,实验证明中药连花清瘟胶囊对治疗新冠肺炎有明显疗效,G是其有效药理成分之一,存在如图转化关系:

下列有关说法正确的是
A.化合物Ⅱ中所有碳原子可能都共面
B.化合物Ⅰ分子中有3个手性碳原子
C.化合物G、Ⅰ、Ⅱ均能发生氧化反应、取代反应、消去反应
D.若在反应中,G与水按1:1发生反应,则G的分子式为C16H20O10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某元素的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,各物质转化关系如图所示。下列说法正确的是
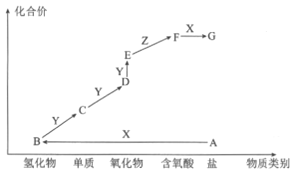
A. A是可与草木灰混合使用的肥料 B. C可用排空气法收集
C. F和B能发生复分解反应生成盐 D. B在一定条件下可直接与Y反应生成D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第四周期元素中价层成对电子数与基态Mg价层成对电子数相等的元素有_________种。
(2)吡咯(平面形结构,结构式为![]() ),N原子杂化方式为______。多原子分子中的大π键可用符号
),N原子杂化方式为______。多原子分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______。
(3)一种锰的氧化物的晶胞如图甲,请写出该氧化物的化学式______。若沿z轴方向观察该晶胞,可得投影图如图乙,请画出沿y轴方向的投影图______。

(4)某含Mg储氢晶体储氢后转化为MgH2,MgH2晶体的结构如图丙,晶胞参数a=b=450pm,c=301pm,原子分数坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。

①该晶体中Mg的配位数是__________。
②Mg2+的半径为72pm,则H-的半径为____________pm(列出计算表达式)
③用NA表示阿伏伽德罗常数,则MgH2晶体中氢的密度是标准状况下氢气密度的_______倍(列出计算表达式,氢气密度为0.089g·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:

已知:反应Ⅱ包含2NaHSO3![]() Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:____________________________________________。
(2)“灼烧”时发生反应的化学方程式:__________________________________________。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:________________________。
(4)副产品X的化学式是:____________;可循环利用的物质是:__________________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com