
|
已知Mg(OH)2的溶度积Ksp=1.8×10-11 mol3·L-3,则其饱和溶液中的pH为 | |
| [ ] | |
A. |
3.48 |
B. |
3.78 |
C. |
10.52 |
D. |
10.22 |
科目:高中化学 来源: 题型:
某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
请根据以上流程,回答以下问题:
(1)操作①的名称:________;操作②的方法是:_____________;要从橙红色液体中分离出溴,可采取的操作名称是_ ____。
(2)操作③要得到较纯的固体B,其操作步骤包括 ,需要的玻璃仪器有:_________________。
(3)某同学提出一种新方案,对上述操作①后无色溶液进行除杂提纯,其方案如下:
(i)试剂A中有两种溶质,它们是 ,试剂B成分是 。(填化学式)
(ii)检验SO42-已除尽的方法是_________________________________________。
(ⅲ)用盐酸调节溶液的pH至pH=5的目的是 。
(ⅳ)进行操作⑤时,将溶液倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
(ⅴ)控制溶液pH=12可确保Mg2+除尽,此时溶液中Mg2+物质的量浓度为 。
(已知Mg(OH)2的Ksp=1.6×10-11)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省荆州市高三3月第二次质量检查理综化学试卷(解析版) 题型:填空题
镁是“国防金属”,从海水中提取镁通常要经历三大步骤见下图:

请回答下列问题:
(1)步骤1是提高海水中Mg2+浓度,方法是 。
(2)步骤2的离子方程式为 。
已知Mg(OH)2的Ksp=5.61×10-12,假设浓缩海水中MgCI2浓度为3mo1/L,则要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到 。
工业生产为了获得更高的利润,根据表1分析,最合理的沉淀剂是_ ,生产这种沉淀剂的方法是 。
表1试剂价格
|
试剂 |
KOH |
NaOH |
Ca(OH)2 |
|
价格(元/吨) |
6800 |
3200 |
1200 |
(3)步骤3如何实现?两位同学设计下列方案:
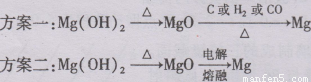
这两种方案是否合理?请你评价:
方案一: 。
方案二: 。
你的设计方案是什么?写出流程图:
。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三上学期期末考试化学试卷 题型:选择题
下表中对实验操作、现象的描述及对应的解释、结论正确的是
|
选项 |
实验操作、现象 |
解释、结论 |
|
A. |
铜片放入浓硫酸中,无明显变化 |
铜在冷的浓硫酸中会发生钝化 |
|
B. |
往某氯化物溶液中滴加氨水,产生白色沉淀 |
该氯化物是AlCl3 |
|
C. |
将10ml某pH=3的HA溶液加水稀释到100ml,所得溶液pH=3.8 |
HA是弱酸 |
|
D. |
往MgCl2溶液中滴加NaOH溶液,调至pH=9时,开始出现沉淀[已知Mg(OH)2的Ksp=5.6×10-12] |
原溶液中 c(Mg2+)=5.6×10-2mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:2010届南京一中高三考前冲刺化学卷 题型:实验题
某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:


请根据以上流程,回答以下问题:
(1)操作①的名称:________;操作②的方法是:_____________;要从橙红色液体中分离出溴,可采取的操作名称是_ ____。
(2)操作③要得到较纯的固体B,其操作步骤包括 ,需要的玻璃仪器有:_________________。
(3)某同学提出一种新方案,对上述操作①后无色溶液进行除杂提纯,其方案如下:

(i)试剂A中有两种溶质,它们是 ,试剂B成分是 。(填化学式)
(ii)检验SO42-已除尽的方法是_________________________________________。
(ⅲ)用盐酸调节溶液的pH至pH=5的目的是 。
(ⅳ)进行操作⑤时,将溶液倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
(ⅴ)控制溶液pH=12可确保Mg2+除尽,此时溶液中Mg2+物质的量浓度为 。
(已知Mg(OH)2的Ksp=1.6×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:


请根据以上流程,回答以下问题:
(1)操作①的名称:________;操作②的方法是:_____________;要从橙红色液体中分离出溴,可采取的操作名称是_ ____。
(2)操作③要得到较纯的固体B,其操作步骤包括 ,需要的玻璃仪器有:_________________。
(3)某同学提出一种新方案,对上述操作①后无色溶液进行除杂提纯,其方案如下:

(i)试剂A中有两种溶质,它们是 ,试剂B成分是 。(填化学式)
(ii)检验SO42-已除尽的方法是_________________________________________。
(ⅲ)用盐酸调节溶液的pH至pH=5的目的是 。
(ⅳ)进行操作⑤时,将溶液倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
(ⅴ)控制溶液pH=12可确保Mg2+除尽,此时溶液中Mg2+物质的量浓度为 。
(已知Mg(OH)2的Ksp=1.6×10-11)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com