
| A. | 食物储存在冰箱里 | |
| B. | 用MnO2作H2O2分解反应的催化剂 | |
| C. | 用块状碳酸钙代替粉末状碳酸钙与稀盐酸反应 | |
| D. | 用1 mol/L H2SO4溶液代替3 mol/L H2SO4溶液与锌粒反应 |
分析 加快反应速率,可升高温度、增大浓度、压强、增大故体表面积或加入催化剂等,以此解答该题.
解答 解:A、将食物储存在冰箱里,降低温度可以减慢反应速率,故A错误;
B、往H2O2溶液中加入少量MnO2,MnO2作催化剂,可以加快化学反应速率,故B正确;
C、块状碳酸钙代替粉末状碳酸钙,减小了固体的表面积,反应速率减慢,故C错误;
D、用1 mol/L H2SO4溶液代替3 mol/L H2SO4溶液与锌粒,减小了氢离子的浓度,反应速率减慢,故D错误.
故选B.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力和基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:多选题
| A. | ②④ | B. | ②③④ | C. | ②④ | D. | ②④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 滤液A中不含Fe3+ | |
| B. | 样品中含氧元素的物质的量为0.01mol | |
| C. | 上图中V=112 | |
| D. | 溶解样品的过程中消耗的硫酸的总的物质的量为0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
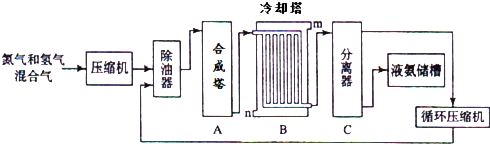
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(C)=0.5mol/(L•s) | B. | v(D)=0.4mol/(L•s) | C. | v(B)=0.6mol/(L•s) | D. | v(A)=9.0mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大 | |
| B. | 增大反应物浓度,单位体积内活化分子数增多,有效碰撞的几率增大,反应速率增大 | |
| C. | 具有足够能量的分子相互碰撞就一定能发生化学反应 | |
| D. | 正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的电子式: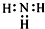 | |
| B. | S2-的结构示意图: | |
| C. | 中子数为146、质子数为92的铀(U)原子${\;}_{92}^{146}$U | |
| D. | 氮气分子的结构式:N-N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不用稀硫酸,改用98%浓硫酸 | B. | 加入更多锌片 | ||
| C. | 加入适量的氯化钠溶液 | D. | 加入数滴氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com