
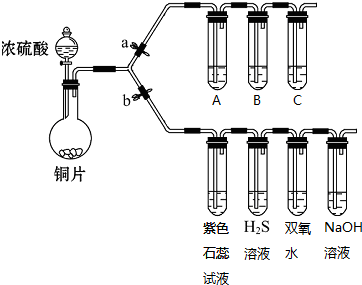
分析 (1)①二氧化硫中硫元素的化合价是+4价,被硫化氢中-2价的硫还原生成S单质,据此写出反应的化学方程式;
②二氧化硫溶于水生成亚硫酸,亚硫酸具有酸性,能够使紫色石蕊试液变红;
③双氧水与二氧化硫发生氧化还原反应生成硫酸;
(2)二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强;
(3)二氧化硫与氯化铁、硝酸钡反应都具有明显现象,而与氯化钙不反应,与氢氧化钠和亚硫酸钠反应,但是没有明显现象,据此进行判断.
解答 解:(1)①二氧化硫中硫元素的化合价是+4价,具有氧化性,二氧化硫气体与H2S溶液常温下反应,生成黄色固体硫(单质)和水,反应的方程式为:2H2S+SO2═3S↓+2H2O,
故答案为:2H2S+SO2═3S↓+2H2O;
②二氧化硫为酸性氧化物,其水溶液呈酸性,则紫色石蕊试液变红,
故答案为:变红;
③双氧水具有强氧化性,能够将二氧化硫氧化成硫酸,反应的离子方程式为:H2O2+SO2=SO42-+2H+,
故答案为:H2O2+SO2=SO42-+2H+;
(2)二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,所以盛有Na2SiO3溶液的试管中出现白色沉淀即说明碳酸酸性比硅酸强,
故答案为:C中盛有Na2SiO3溶液的试管中出现白色沉淀;
(3)a.二氧化硫与铁离子发生氧化还原反应生成亚铁离子,则观察到溶液由棕黄色变为浅绿色,有明显现象,故a错误;
b.Ba(NO3)2和二氧化硫发生氧化还原反应生成硫酸钡沉淀和NO,则观察到产生白色沉淀,有无色气体产生,该气体遇空气变为红棕色,具有明显现象,故b错误;
c.CaCl2,因盐酸的酸性大于亚硫酸的酸性,二者不反应,则无明显现象,故c正确;
d.Na2SO3与二氧化硫反应生成亚硫酸氢钠,但是没有明显现象,故d正确;
e.NaOH与二氧化硫反应生成亚硫酸钠或亚硫酸氢钠,但没有明显现象,故e正确;
故答案为:cde.
点评 本题考查了性质实验方案的设计,题目难度中等,明确常见物质的性质具有检验方法为解答关键,侧重考查二氧化硫的性质及检验方法,注意掌握性质实验方案设计与评价的原则,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:8 | |
| B. | 还原产物为NH4+ | |
| C. | 若有1molNO3-参加还原反应,转移8mol e- | |
| D. | 该反应中H2O是反应物之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 | |
| B. | 苯及其同系物均不能使溴水和酸性高锰酸钾溶液褪色 | |
| C. | 苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构 | |
| D. | 乙酸和乙醇在浓硫酸作用下可以反应,该反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO在平衡时转化率为10% | |
| B. | 平衡浓度c(CO2)=c(H2) | |
| C. | 其他条件不变时,缩小体积,反应②平衡不移动 | |
| D. | 平衡时增大碳的质量,反应①中热量值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 线型结构的高分子材料分子间是靠分子间作用力紧密结合的,所以它的强度一定小 | |
| B. | 从实验测得的某高分子化合物的相对分子质量和小分子的相对分子质量含义不同 | |
| C. | 硫化橡胶为体型网状结构 | |
| D. | 线型结构的高分子,可带支链,也可不带支链 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH3是非极性分子 | B. | PH3分子中有未成键的电子对 | ||
| C. | PH3是强氧化剂 | D. | PH3分子中的P-H键是非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com