
【题目】关于下列各图的叙述错误的是![]()
化学方程式 | 平衡常数K |
|
|
|
|
|
|
|
|
A.已知1molCO燃烧放出的热为283kJ,![]() ;
;![]() 则
则 表示CO和
表示CO和![]() 生成
生成![]() 和
和![]() 的能量变化
的能量变化
B.常温下![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后溶液的
溶液等体积混合后溶液的![]() ,则混合溶液中离子浓度的大小顺序为:
,则混合溶液中离子浓度的大小顺序为:![]()
C.常温下,![]() 和
和![]() 反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时
反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时![]() 从
从![]() 到
到![]() 的转化率逐减小,且HX的还原性逐渐减弱
的转化率逐减小,且HX的还原性逐渐减弱
D.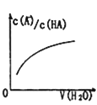 中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况
的变化情况
科目:高中化学 来源: 题型:
【题目】下列电子式书写正确的是( )
①氧原子![]() ②过氧根离子
②过氧根离子![]() ③氢氧根离子
③氢氧根离子![]() ④钠离子[Na]+⑤氢离子H+⑥铵根离子
④钠离子[Na]+⑤氢离子H+⑥铵根离子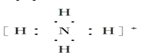 ⑦铝原子
⑦铝原子![]() ⑧溴离子
⑧溴离子![]()
A.①②③⑥⑦B.①③⑥⑦⑧
C.①③⑤⑥⑦⑧D.②③④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】IBr、ICl等称之为卤素互化物,![]() 、
、![]() 、
、![]() 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
![]() 氯化碘
氯化碘![]() 能与水发生反应:
能与水发生反应:![]() ,该反应_______
,该反应_______![]() 填“是”或“不是”
填“是”或“不是”![]() 氧化还原反应。
氧化还原反应。
![]() 溴化碘
溴化碘![]() 具有强氧化性,能与
具有强氧化性,能与![]() 溶液发生反应,发生反应的离子方程式为___。
溶液发生反应,发生反应的离子方程式为___。
![]() 已知某些离子的还原性强弱顺序为
已知某些离子的还原性强弱顺序为![]() 。现将几滴KSCN溶液滴入到含少量
。现将几滴KSCN溶液滴入到含少量![]() 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性![]() 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______________。
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______________。
![]() 下列物质中,也可以使该溶液红色褪去的是 _________。
下列物质中,也可以使该溶液红色褪去的是 _________。
A.新制氯水 ![]() 碘水
碘水 ![]()
![]() 盐酸
盐酸
![]() 为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将
为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将![]() 氧化为
氧化为![]() 和一种单质气体,该反应的离子方程式为_______________。
和一种单质气体,该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]()
项目 | 相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 水中溶解性 |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
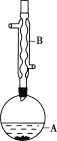
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:
(1)仪器B的名称是___。
(2)在洗涤操作中,第一次水洗和第二次水洗的主要目的分别是___。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后__(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)实验中加入少量无水MgSO4的目的是___。
(5)本实验的产率是___(填标号)。
a.30% b.40% c.60% d.90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班在实验室进行制取乙酸乙酯并对其性质进行探究的分组实验,主要步骤如下:
I.为探究乙酸乙酯的水解反应,某组同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
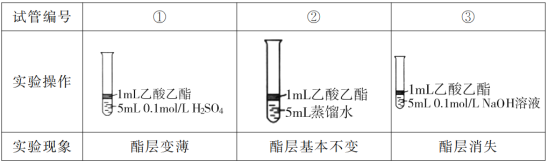
(1)设计实验①和②,是为了探究___对乙酸乙酯的水解的影响。
(2)试管③中反应的化学方程式是__。
Ⅱ.某组同学为验证醋酸、碳酸与苯酚三者酸性的强弱,经过慎重考虑,设计如下实验装置。已知A中装有醋酸,D中装有苯酚钠,请回答问题:
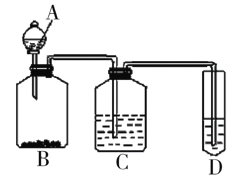
(1)C所盛放的药品是___,装置C的作用___。
(2)试描述能证明三种酸的酸性强弱的实验现象___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间。下列有关反应的化学方程式不正确的是( )
A. (CN)2+H2=2HCN
B. MnO2+4HCN=Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合液中通入少量Cl2:Cl2+2KCN=2KCl+(CN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为_____________________________________。
(2)下列实验能比较镁和铝的金属性强弱的是____________(填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/L AlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 = -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是_____________________________。
(4)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) ![]() Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是_________ mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应______(填“增大”、“减小”或“不变”)。
(5)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=_______________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为______以上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B. NaHCO3在水溶液中的电离方程式:NaHCO3= Na++H++CO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子![]() 或化学
或化学![]() 方程式正确的是
方程式正确的是
A.苯酚钠溶液中通入少量二氧化碳:![]() +H2O+CO2→
+H2O+CO2→![]() +CO32-
+CO32-
B.CH3CO18OC2H5在稀硫酸催化下水解:CH3CO18OC2H5+H2O![]() CH3COOH+C2H518OH
CH3COOH+C2H518OH
C.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
D.乙烯通入到溴水中:H2C=CH2+Br2→C2H4Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com