
分析 发生反应为:Fe+2HCl═FeCl2+H2↑①Fe+H2SO4═FeSO4+H2↑②,如果对于这两个反应都是铁不足的话就不可能是气体质量比是3:4,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量;通过方程式可以看出来,铁消耗HCl的物质的量多,那么对于①反应来说是盐酸不足,可以计算出生成H2为0.15mol,根据质量比可算出来②反应生成H2为0.2mol,对于②反应是Fe不足,以此计算铁的质量.
解答 解:由于最后生成的气体质量不等,所以证明盐酸反应不足,而硫酸过量,否则生成气体的质量之比应该是1:2,
Fe+2HCl═FeCl2+H2↑①
生成气体的物质的量为:$\frac{0.1L×3mol/L}{2}$=0.15mol,氢气的质量为:0.15moL×2g/mol=0.3g,
反应完毕后生成气体的质量之比为3:4,所以由硫酸生成的气体质量为0.4g,
设铁的质量为x,
Fe+H2SO4═FeSO4+H2↑②
56 2
x 0.4g
则:$\frac{56}{x}$=$\frac{2}{0.4}$,解得:x=11.2g,
故答案为:11.2g.
点评 本题考查化学方程式的计算,题目难度不大,明确发生反应原理为解答关键,注意根据反应方程式正确判断过量情况,试题有利于提高学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
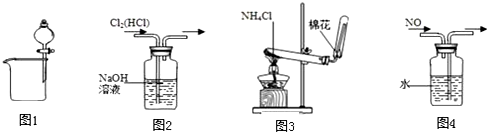
| A. | 图1可用于分离碘酒中的碘和酒精 | B. | 图2可用于除去Cl2中的HCl | ||
| C. | 图3可用于实验室制取氨气 | D. | 图4可用于排水集气法收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组同学发现84消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混合有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2.
某化学小组同学发现84消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混合有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图Ⅰ研究的是t1时刻增大压强(缩小体积)对反应速率的影响 | |
| B. | 图Ⅱ研究的是t1时刻通入氦气(保持恒容)对反应速率的影响 | |
| C. | 图Ⅱ研究的是t1时刻加入正催化剂对反应速率的影响 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、Na2CO3、BaCl2、HCl | B. | Na2CO3、BaCl2、HCl、NaOH | ||
| C. | BaCl2、HCl、NaOH、Na2CO3 | D. | NaOH、BaCl2、Na2CO3、HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com