
| A. | NO2 | B. | CO | C. | C6H6(g) | D. | CO2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
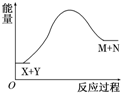
| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
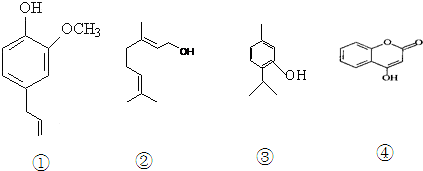
 .
.  .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
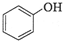
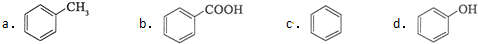
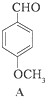 $→_{H+}^{KMnO_{4}}$[B]$→_{浓硫酸,△}^{CH_{3}OH}$
$→_{H+}^{KMnO_{4}}$[B]$→_{浓硫酸,△}^{CH_{3}OH}$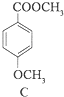
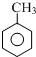 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$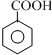
 .
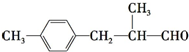
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
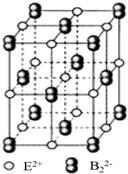 原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.
原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.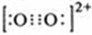 ;1mol D22+中含有的π键数目为2NA.
;1mol D22+中含有的π键数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝在生产、生活中得到广泛的应用,主要是因为其可用热还原法冶炼 | |
| B. | 对“地沟油”蒸馏可以获得汽油 | |
| C. | 氯气常用于自来水的消毒,是利用了氯气的强氧化性来杀菌消毒 | |
| D. | 化石燃料使用过程中排放的硫、氮的氧化物是形成酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求回答下列问题:
为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com