
| A | B |
| ②使溴的四氯化碳溶液褪色; ②比例模型为: 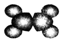 ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成; ②球棍模型为: 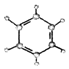 |
 .
. 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
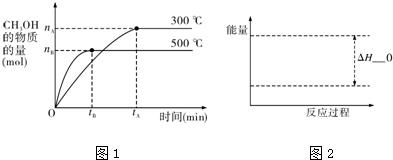
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L四氯化碳的分子数约为NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.2NA | |
| C. | 16gO2和O3的混合气体中所含的原子数为NA | |
| D. | 1mo1•L-1的A1C13溶液中,C1-离子的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T(℃) | NO初始浓度 (mol/L) | C O初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
| 1 | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| 2 | 124 | |||
| 3 | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

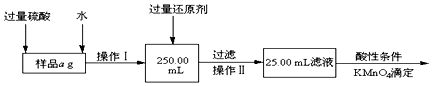
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com