
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| △c |
| △t |
| 消耗量 |
| 起始量 |
| c(C8H10) |
| c(C8H8)c(H2) |
| △c |
| △t |
| ||
| 20min |
| c(C8H8)?c(H2) |
| c(C8H10) |
| 0.10×0.10 |
| 0.10 |
| 消耗量 |
| 起始量 |
| 0.25mol |
| 050mol |
| c(C8H10) |
| c(C8H8)c(H2) |
| 0.125 |
| 0.125×0.125 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、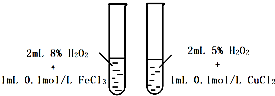 探究不同催化剂对H2O2分解速率影响 |
B、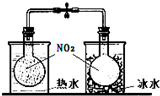 探究温度对2NO2?N2O4平衡影响 |
C、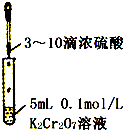 验证Cr2O72-+H2O?2CrO42-+2H+平衡状态变化 |
D、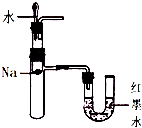 验证钠和水反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
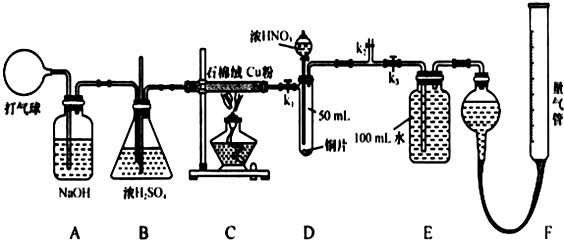
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应产物的总能量大于反应物的总能量时,△H<0 |
| B、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
| C、△H<0、△S>0的反应在温度低时不能自发进行 |
| D、一个化学反应的△H仅与反应的起始状态和反应的最终状态有关,与反应途径无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com