
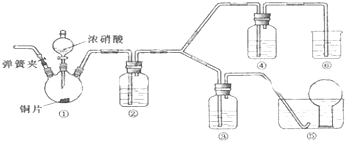
分析 验证浓硝酸的氧化性,应首先检查装置的气密性,硝酸与铜发生反应生成二氧化氮,通入水后生成一氧化氮,然后通过浓硝酸,如无色气体生成红棕色气体,可证明硝酸具有氧化性,可氧化一氧化氮,生成的气体不能直接排放到空气中,应有尾气处理装置,以此解答该题.
(1)结合实验目,根据装置特点分析各装置的作用,再根据物质的性质的判断,装置③、④、⑥中盛放的药品依次是3mol/L稀硝酸、浓硝酸、氢氧化钠溶液;
(2)由于装置中残存的空气能氧化NO而对实验产生干扰,需要先通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出;
(3)装置①中铜与浓硝酸反应生成硝酸铜、二氧化氮与水;
(4)进入装置②中的气体为二氧化氮,二氧化氮与水反应生成硝酸与NO;
(5)根据对比实验③、④的实验现象判断;
(6)根据是否改变溶液中硝酸铜的质量分数或溶解气体的浓度判断.
解答 解:(1)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2防止污染大气;因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸.
故答案为:3mol/L稀硝酸、浓硝酸、氢氧化钠溶液;
(2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出,
故答案为:通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内;
(3)装置①中Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O,反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,离子反应为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(4)装置①中反应生成了二氧化氮,在装置②中二氧化氮会与水反应,即3NO2+H2O=2HNO3+NO,所以装置②的作用是将NO2转化为NO,
故答案为:将NO2转化为NO;3NO2+H2O=2HNO3+NO;
(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之.装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体,
故答案为:装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色;
(6)要证明是Cu(NO3)2浓度过低或是溶解了NO2导致装置①中溶液呈绿色,一是可设计将溶解的NO2赶走,再观察颜色变化,a、c方案符合;二是增加溶液中Cu(NO3)2溶液的浓度,观察反应后的颜色变化,d方案符合.
故选:a c d.
点评 本题主要考查HNO3的性质、属物质验证性实验设计,利用对比的方法判断硝酸的性质.结合已知的物质具有的性质,选择合适的试剂,设计具体实验方案验证物质是否具有该性质.对有毒气体要设计尾气处理装置,防止污染环境,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+l价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
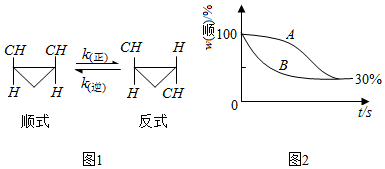
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
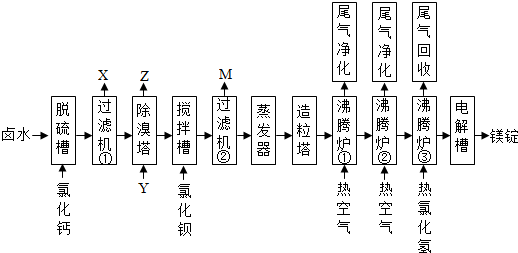
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X的最高正价和最低负价的绝对值相等,Y有三个能级,且每个能级上的电子数相等,Z原子未成对电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X的最高正价和最低负价的绝对值相等,Y有三个能级,且每个能级上的电子数相等,Z原子未成对电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
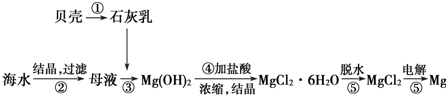
| A. | 用此法提取镁的优点之一是原料来源丰富 | |
| B. | 电解MgCl2时阳极产生镁 | |
| C. | 步骤⑤可将晶体置于HCl气体氛围中脱水制无水氯化镁 | |
| D. | 上述工艺流程中涉及到化合、分解和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
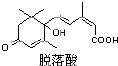 脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构如图所示:则有关脱落酸的说法正确的是 ( )
脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构如图所示:则有关脱落酸的说法正确的是 ( )| A. | 脱落酸的化学式C15H18O4 | |
| B. | 脱落酸只能和醇类发生酯化反应 | |
| C. | 1 mol 脱落酸最多可以和2 mol 金属钠发生反应 | |
| D. | 1 mol 脱落酸最多可以和2 mol 氢气发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com