
| A. | NH4+、Ba2+、NO3-、CO32- | B. | Fe2+、OH-、SO42-、MnO4- | ||
| C. | Na+、Mg2+、NO3-、SO42- | D. | Na+、Fe3+、Cl-、AlO2- |
分析 pH=1的溶液中存在大量氢离子,无色溶液时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.钡离子、氢离子与碳酸根离子反应;
B.亚铁离子与氢氧根离子、高锰酸根离子反应,氢氧根离子与氢离子反应;
C.四种离子之间不反应,都不与氢离子反应;
D.铁离子、氢离子与偏铝酸根离子反应.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,pH=1的溶液为酸性溶液,溶液中存在大量的H+,
A.Ba2+、H+与CO32-之间发生反应,在溶液中不能大量共存,故A错误;
B.Fe2+与OH-、H+、MnO4-反应,OH-、H+之间反应,在溶液中不能大量共存,故B错误;
C.Na+、Mg2+、NO3-、SO42-之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.Fe3+、H+与AlO2-之间发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在等.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:解答题
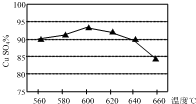 将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).| 粒子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0mol•L-1 | B. | 3.5mol•L-1 | C. | 4.0mol•L-1 | D. | 8.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
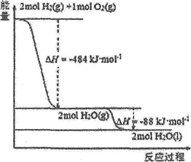 已知:H-H、O=O的键能分别是436kJ•mol-1和496kJ•mol-1.依据图,则H-O的键能是( )
已知:H-H、O=O的键能分别是436kJ•mol-1和496kJ•mol-1.依据图,则H-O的键能是( )| A. | 926 kJ•mol-1 | B. | 485 kJ•mol-1 | C. | 463 kJ•mol-1 | D. | 221 kJ•moI-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑦ | B. | ②⑤⑥ | C. | ②③⑦ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com