
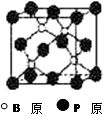
 (1分)(2)B (1分)
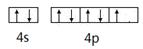
(1分)(2)B (1分)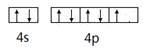 。
。

科目:高中化学 来源:不详 题型:单选题
| A.冰熔化时,分子中H—O键发生断裂 |
| B.原子晶体中,共价键的键长越短,键能越大,熔点就越高 |
| C.分子晶体中,共价键键能越大,该分子的熔沸点就越高 |
| D.分子晶体中,分子间作用力越大,则分子越稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 代号 | 物质 | 结构简式 | 水中溶解度/g (25℃) | 熔点/℃ | 沸点/℃ |
| A | 对—硝基苯酚 | 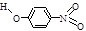 | 1.7 | 114 | 295 |
| B | 邻—硝基苯酚 | 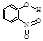 | 0.2 | 45 | 100 |
| | 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| 甲 | 187 | 202 | 2.6 |
| 乙 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配合物中中心原子的电荷数和配位数均为6 |
| B.该配合物可能是平面正方形结构 |
| C.Cl-和NH3分子均与Pt4+配位 |
| D.配合物中Cl-与Pt4+配位,而NH3分子与Pt4+不配位 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氮气的化学性质没有氯气活泼 | B.HF比HCl稳定 |
| C.金刚石的熔点比晶体硅高 | D.常温下溴呈液态,碘呈固态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含氢元素的化合物中一定有氢键 |
B.因为氢键的缘故,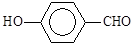 比 比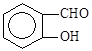 熔沸点高 熔沸点高 |
| C.由于氢键比范德华力强,所以H2O分子比H2S分子稳定 |
| D.“可燃冰”——甲烷水合物(例如:8CH4·46H2O)中CH4与H2O之间存在氢键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AlCl3为离子化合物 | B.SiCl4为共价化合物 |
| C.P 与Cl可形成离子键 | D.K与Mg 形成共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 分子或离子 | 孤对电子对数 | VSEPR模型名称 | 中心原子杂化轨道类型 | 分子或离子的立体构型名称 |
| CH4 | 0 | 正四面体形 | sp3 | 正四面体形 |
| BeCl2 | | | | |
| SO2 | | | | |
| CH3+ | | | | |
| SO42- | | | | |
| NCl3 | | | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com