
| A. | Al | B. | Zn | C. | Fe | D. | Mg |
分析 稀硫酸浓度降低,说明金属与稀硫酸反应生成氢气,令金属的相对原子质量为a、反应中化合价为b,消耗一般硫酸时金属有剩余,根据电子转移守恒列不等式,结合选项讨论确定,注意钠能够与水反应.
解答 解:参加反应的硫酸物质的量=0.1L×4mol/L×$\frac{1}{2}$=0.2mol,设金属的相对原子质量为a、反应中化合价为b,金属还没有全部溶解,根据电子转移守可知:$\frac{5}{a}$×b>0.2×2,整理可得:a<12.5b,
A.反应中Al为+3价,则a=$\frac{5×3}{0.4}$=37.5,故A符合;
B.反应中Zn为+2价,则a=25<$\frac{5×2}{0.2}$=50,故B不符合;
C.反应中Fe为+2价,则a=25<$\frac{5×2}{0.2}$=50,故C不符合;
D.反应中Mg为+2价,则a=24<$\frac{5×2}{0.2}$=50,故D不符合;
故选A.
点评 本题考查根据方程式计算、氧化还原反应计算,难度不大,注意利用电子转移守恒方法简化计算,转移讨论法的利用.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:实验题
 某化学小组用以下装置做兴趣实验(试管中有空气存在).
某化学小组用以下装置做兴趣实验(试管中有空气存在).| 实验编号 | a中试剂 | b中试剂 |
| 1 | 0.1克Na、3mL水 | 0.1克Na、3mL乙醇 |
| 2 | 铁钉、3mL饱和食盐水 | 铁钉、3mL饱和氯化铵 |
| 3 | 3mL水 | 3mL饱和FeSO4溶液 |
| 4 | 3mL浓硝酸、1g铝片 | 3mL浓硝酸、1g铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
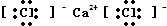 H2O的结构式H-O-H.
H2O的结构式H-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
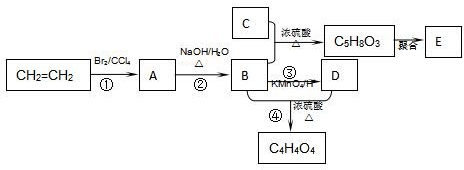
 .
.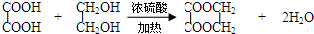 .
.
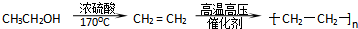
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、BaCl2、Na2CO3、HCl | B. | BaCl2、HCl、Na2CO3、NaOH | ||
| C. | BaCl2、Na2CO3、HCl、NaOH | D. | Na2CO3、NaOH、BaCl2、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1 K2SO4溶液中含有的钾离子数为2NA | |
| B. | 1mol氯气完全反应生成氯离子得到的电子数为NA | |
| C. | 22 g CO2中含有的分子数为NA | |
| D. | 常温常压下,22.4 L N2中含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K层多 | B. | L层多 | C. | 相等 | D. | 不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com