
【题目】已知反应COCl2(g)![]() CO(g)+Cl2(g) △H>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦增加COCl2的浓度;能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦增加COCl2的浓度;能提高COCl2转化率的是
A. ①④⑦ B. ③⑤⑥ C. ②③⑦ D. ①④⑥
【答案】D
【解析】
化学反应COCl2(g)![]() CO(g)+Cl2(g) △H>0,正反应是气体体积增大的吸热反应,
CO(g)+Cl2(g) △H>0,正反应是气体体积增大的吸热反应,
①升温平衡向正反应移动,COCl2转化率增大,故①符合;
②恒容通入惰性气体,总压增大,反应混合物各组分的浓度不变,平衡不移动,COCl2转化率不变,故②不符合;
③增加CO的浓度,平衡向逆反应方向移动,COCl2转化率减小故③不符合;
④减压平衡向正反应方向移动, COCl2转化率增大,故④符合;
⑤加催化剂,改变速率不改变平衡,COCl2转化率不变,故⑤不符合;
⑥恒压通入惰性气体,压强增大,为保持恒压,体积增大浓度减小,平衡正向进行,COCl2转化率增大,故⑥符合;
⑦增加COCl2的浓度,恒容条件下,相当于加压,平衡逆向移动,COCl2转化率减小,故⑦不符合。
综合以上分析①④⑥符合,故答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________、____________________________,制得等量H2所需能量较少的是_____________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中。2 min后,反应达到平衡,水的物质的量为0.01mol。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中。2 min后,反应达到平衡,水的物质的量为0.01mol。
① H2S的平衡转化率α=_______%
②从反应开始到平衡,CO2的平均反应速率为_________________
(3)在一定条件下,用H2O2氧化H2S。随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。在酸性溶液中,当n(H2O2)/n(H2S)=4时,写出离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或现象不能用勒沙特列原理解释的是
|
|
A.卤化银沉淀的转化 | B.配制FeCl3溶液 |
|
|
C.酯水解程度比较 | D.探究石灰石与稀盐酸在密闭环境下的反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福韦酯(TDF)主要用于治疗艾滋病毒(HIV)感染,化合物W是合成TDF的重要中间体,其合成路线如图所示。
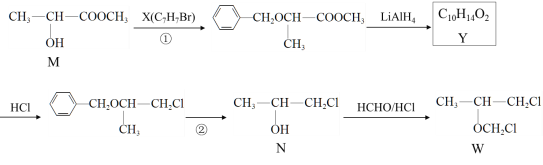
完成下列填空:
(1)N所含官能团的名称是______________;Y的结构简式是____________________。
(2)X可用苯的一种同系物制备,所需的无机试剂与条件是____________________。
(3)写出检验W中是否有残留甲醛的化学方程式____________________________________。
(4)①②的目的是_______________________。
(5)写出M符合下列条件的一种同分异构体的结构简式。_______________
i. 与M具有相同官能团 ii. 能发生银镜反应
(6)写出用M为原料制备聚丙烯酸( )的合成路线_______________________ 。
)的合成路线_______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_________________________。
(2)灼烧用的仪器_________________填名称)。
(3)沉淀A的成分是______________(填化学式)。
(4)冶炼铝的化学方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲用下列装置制备氯水并探究其性质。
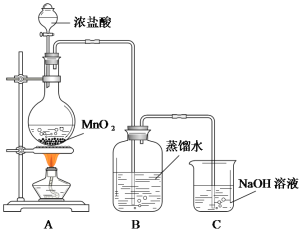
已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)C装置的作用是__________________________________。
(2)氯水制备完成后,甲同学从B中取出一定量的样品置于日光下照射一段时间,发现样品某些性质发生了明显的变化,请各列举一项:
物理性质变化:______________________________________________________;
化学性质变化:_______________________________________________________。
(3)乙同学从B中取出一定量的样品后通入SO2,充分作用后再滴入少量品红溶液,发现品红溶液不褪色。原因是__________________________________(用离子方程式表示)。丙同学改变通入SO2的量,重复乙同学的操作,发现品红溶液红色褪去。他提出:假设①:SO2过量,多余的SO2使品红溶液褪色;假设②:_________________________。请设计实验验证假设①是否成立:______________________。
(4)为证明氯气与水反应产物具有漂白性,丁同学将A中产生的气体缓缓通过下列装置:

试剂a应选择_______________;试剂b应选择_______________。
(5)戊同学从B中取出少量样品,滴到NaHCO3粉末上,有无色气泡产生,由此他认为氯气与水反应至少产生一种酸性强于碳酸的物质。请评价他的观点是否正确并说明理由________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,CO和CH4燃烧的热化学方程式为:CO(g)+1/2O2=CO2(g);△H=-283KJ/mol
CH4(g)+2O2=CO2(g)+2H2O(g);△H=-890KJ/mol,现有4mol CO和CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为2953KJ,则CO和CH4的体积比
A. 1:3 B. 3:1 C. 1:2 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关元素周期表的说法中错误的是( )
A.元素周期表中第16个纵行为ⅥA族
B.ⅦA族元素也称为卤族元素
C.0族元素的原子最外层电子数均为8,元素化合价为0
D.元素周期表中,Ⅷ族包括第8,9,10三个纵行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com