
 3Cu2++2R+yH2O。
3Cu2++2R+yH2O。科目:高中化学 来源:不详 题型:单选题
A.可以收集到氯气 L L |
| B.反应后溶液中的Cl-数目为2aNA/87 |
C.NA可表示为 |
| D.反应后溶液中的H+数目为(bc-2d) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
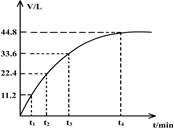
| A.t1 | B.t2 | C.t3 | D.t4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态 |
| B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 |
| C.第②步中,还原0.1 mol Cr2O72-需要45.6 g FeSO4 |
| D.第③步沉淀剂a可以使用NaOH等碱性物质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2N2(g)+3H2O(g) ΔH < 0
2N2(g)+3H2O(g) ΔH < 0 NO2
NO2 N2
N2 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H 0 (填“>”、“<”或“无法确定”);催化剂表面积S1 S2 (填“>”、“<”或“无法确定”)。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H 0 (填“>”、“<”或“无法确定”);催化剂表面积S1 S2 (填“>”、“<”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.电解时发生反应的化学方程式为2HCl Cl2↑+H2↑ Cl2↑+H2↑ |
| B.由NaClO2溶液制取0.6 mol ClO2时,至少消耗0.1 mol NCl3 |
| C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3 |
| D.溶液X的主要成分为NaClO2和NaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.开始加入合金的质量可能为16.4 g |
| B.参加反应的硝酸的物质的量为0.1 mol |
| C.生成沉淀完全时消耗NaOH溶液的体积为100 mL |
| D.标准状况下产物NO的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学方程式中产物分子的化学计量数由小到大的顺序是SO2、N2、NH3、H2O |
| B.氧化产物和还原产物的物质的量之比为3∶1 |
| C.被氧化元素原子和被还原元素原子的物质的量之比为2∶3 |
| D.若反应生成1 mol H2O,则转移的电子为6 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应后溶液中无硝酸亚铁 |
B.反应前HNO3溶液的浓度为2.0mol |
C.反应后溶液中c(NO3-)=1.6mol |
| D.反应后的溶液最多还能溶解1.6lgFe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com