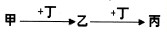(2011?龙岩模拟)甲、乙、丙、丁均为中学常见物质,且甲、乙、丙均含有同一种元素.一定条件下四种物质之间有如图甲所示的转化关系.请回答问题:
(1)若甲、丁分别为铁和氯气中的一种,则丙的酸性溶液露置于空气中将变质.变质过程所发生反应的离子方程式为
4Fe2++O2+4H+═4Fe3++2H2O
4Fe2++O2+4H+═4Fe3++2H2O
.
(2)已知乙、丁均为空气中含量最多的两种单质,且由甲、丁和NaOH溶液构成的新型燃料电池放电时甲与丁作用转化为乙(同时生成一种对生命活动有重要意义的物质),负极反应式为
2NH3+6OH-═N2+6H2O+6e-
2NH3+6OH-═N2+6H2O+6e-
.
(3)图示转化关系对应的反应既可以是非氧化还原反应,也可以是氧化还原反应.
①若丁为盐酸且反应均为非氧化还原反应,则甲的水溶液的pH比丙的水溶液的pH
大
大
(填“大”或“小”).
②若丁为单质,下列关于物质乙、丙所含的同一元素的价态的推断,正确的是
d
d
.
a、乙一定更高 b、丙一定更高 c、乙和丙一样高 d、无法确定
(4)高温下,利用天然气生产合成气的过程涉及上述图示转化关系(生成的H
2未标出),且丙能使石灰水变浑浊、“甲→乙”对应的反应为:CH
4+H
2O-CO+H
2(未配平,条件略).
①当1mol甲与丁反应转化为乙时吸收206.1kJ的热量,1mol乙与丁反应转化为丙时放出41.2kJ的热量.则甲与丁直接转化为乙的热化学方程式为
CH4(g)+2H2O=CO2(g)+4H2(g)△H=+164.9KJ/mol
CH4(g)+2H2O=CO2(g)+4H2(g)△H=+164.9KJ/mol
(丁均为气态).
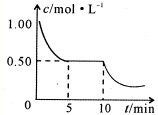
②将甲与丁混合于容积不变密闭容器中,甲将转化为乙,且反应过程中甲浓度变化情况如图所示.试推测:反应10min时,改变的外界条件可能是
降低温度
降低温度
.
③t℃时,乙转化为丙反应化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中乙、丁、丙和氢气的物质的量依次为0.5mol、8.5mol、2.0mol和2.0mol.此时反应正、逆反应速率的关系式是
a
a
(填代号).
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) D.无法判断.

![]()