
【题目】用如图所表示的方法研究金属钠与水反应的性质,其中A是用带孔的铝箔包着的小块的金属钠.

(1)从大块钠上取下的小块钠要用滤纸擦一擦,这样做的目的是_______________。
(2)包裹钠块的铝箔要预先扎上足够多的小孔,若孔数不够,可能出现的不良后果是__________.假如在实验刚开始就将镊子松开拿出水面,A表现出的现象是 _______________________,出现这种现象的原因是______________。
(3)据预测,钠与水反应生成氢气和氢氧化钠.
证明生成氢氧化钠的实验方法和相应的现象是______________________;
(4)已知反应结束后铝箔和钠均消失,请写出相关反应的离子方程式:______________________________
【答案】擦去钠表面上的煤油,避免影响实验效果 发生爆炸 钠浮在水面上 钠的密度小于水,且生成的氢气,增大了A所受的浮力 向烧杯内的溶液中滴入3滴酚酞,溶液变红色 2Na+2H2O=2OH-+H2↑、2Al+2OH-+2H2O=3H2↑+2AlO2-
【解析】
(1)根据实验室中一般将金属钠保存在煤油中分析;
(2)根据钠与水剧烈反应生成氢氧化钠、氢气,并放出大量的热分析;根据金属钠的密度小于水的密度分析;
(3)氢氧化钠是碱,遇酚酞变红色;
(4)钠与水反应生成氢气和氢氧化钠,铝能与氢氧化钠反应,据此解答。
(1)为了防止金属钠被氧气、水所氧化,实验室中一般将金属钠保存在煤油中,在使用金属钠时,为了不影响实验效果,一般要用滤纸擦净其表面上的煤油;
(2)包裹钠块的铝箔要预先扎上足够多的小孔,若孔数不够,可能出现的不良后果是发生爆炸,其原因是:金属钠具有很强的还原性,常温下钠与水剧烈反应生成氢氧化钠、氢气,并放出大量的热,故在封闭的空间内易发生爆炸。假如在实验刚开始就将镊子松开拿出水面,由于金属钠的密度小于水的密度,铝箔的密度也比较小,而且钠与水反应生成的氢气更增大了A所受的浮力,故包有钠的铝箔会浮出水面;
(3)氢氧化钠是碱,遇酚酞变红色,故证明生成氢氧化钠的实验方法和相应的现象为:向烧杯内的溶液中滴入3滴酚酞,溶液变红色;
(4)钠与水反应生成氢气和氢氧化钠,离子方程式为2Na+2H2O=2OH-+H2↑;生成的氢氧化钠能溶解金属铝,反应的离子方程式为2Al+2OH-+2H2O=3H2↑+2AlO2-。


科目:高中化学 来源: 题型:
【题目】已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答下列问题:
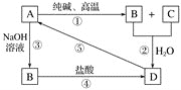
(1)写出化学式:A是____________,D是____________。
(2)写出相关反应的化学方程式:①____________,⑤____________。
(3)写出相关反应的离子方程式:②__________,③__________,④__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,正确的是

A. 装置①不可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
C. 实验室可用装置③收集HCl
D. 验证溴乙烷发生消去反应生成烯烃的实验可利用装置④进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的含氧酸根离子有ClO-、ClO、ClO、ClO等,关于,它们的说法中不正确的是( )
A. ClO-中Cl显+1价 B. ClO的空间构型为直线形
C. ClO的空间构型为三角锥形 D. ClO是SO![]() 的等电子体
的等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是
A.空气、天然气、苛性钾、石灰石B.液氯、氯水、硫酸钠、乙醇
C.盐酸、水煤气、醋酸、干冰D.胆矾、漂白粉、氯化钾、氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(沸点-89.7℃,还原性强)。某化学兴趣小组的同学用下述方法测定粮食中残留磷化物的含量。

在C中加入100g原粮,E中加入20.00mL 1.50×l0-3mol/L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)仪器D的名称是________________________。
(2)AlP与水反应的化学方程式为__________________________________。
(3)装置A中盛装KMnO4溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸( )的碱性溶液,其作用是_____________________________。
)的碱性溶液,其作用是_____________________________。
(4)通入空气的作用是____________________________________。
(5)装置E中PH3被氧化成磷酸,则装置E中发生反应的氧化剂和还原剂物质的量之比为______________。(6)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-4mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液15.00mL,Na2SO3与KMnO4溶液反应的离子方程式为______________, 则该原粮中磷化物(以PH3计)的含量为_____ mg·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂,有多种组成,可表示为 Cua(OH)bClcxH2O。为测定某碱式氯化铜的 组成,进行下列实验:
(1)称取样品 1.1160g,用少量稀 HNO3 溶解后配成 100.00mL 溶液 A;
(2)取 25.00mL 溶液 A,加入足量 AgNO3 溶液,得 AgCl 0.1722g;
(3)另取 25.00mL 溶液 A,调节 pH 45,用浓度为 0.08000molL1 的 EDTA 标准溶液确定 A 中 Cu2+(原理为 Cu2++EDTA═EDTACu2+),消耗 EDTA 标准溶液 30.00mL。通过计算确定该样品的化学式( )
A. Cu2(OH)2Cl23H2O B. Cu2(OH)3ClH2O
C. Cu(OH)Cl2H2O D. Cu2(OH)Cl33H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
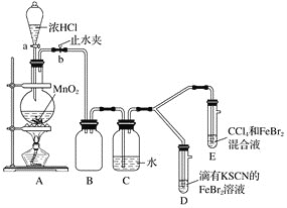
(1)①装置A中发生反应的离子方程式是____________________。
②整套实验装置存在一处明显的不足,请指出__________________。
(2)用改正后的装置进行实验,实验过程如下:_______。
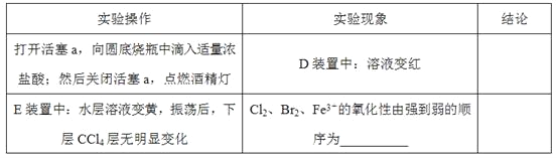
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
i.Fe3+3SCN-![]() Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ii.(SCN)2性质与卤素单质类似、氧化性:Cl2>(SCN)2。
iii.Cl2和Br2反应生辰BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
iv.AgClO、AgBrO均可溶于水。
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因_______,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加___________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com