
 近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | lmolO32mol NO2 | lmolO3 2mol NO2 |
分析 (1)①氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质为氮气和水;
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1.105℃时,结合热化学方程式和盖斯定律计算上述脱硝反应的△H,反应自发进行的判断依据△H-T△S<0;
③反应中氧化剂NO,还原剂为NH3的物质的量之比结合化学方程式电离关系计算,每生成3mol还原产物电子转移12e-;
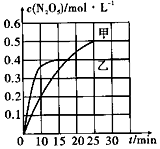
(2)①图象分析可知,N2O5(g)生成浓度0.2mol/L,则消耗O3浓度0.2mol/L,根据v=$\frac{△c}{△t}$计算v(O3);
②由图象分析,先拐先平数值大,则乙的温度较高,T1<T2,温度越高N2O5(g)浓度越小,说明反应逆向移动,正反应是放热反应;
③A.恒容容器中,向容器中充入He,增大容器的总压强,分压不变,平衡不变;
B.反应为放热反应,升高容器的温度,平衡逆向进行;
C.两种反应物增加一种会提高另一种物质转化率,本身转化率减小;
D.向容器中再充入lmol O3和2mo NO2,相当于增大压强,平衡正向进行;
④若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,计算浓度商Qc和平衡常数比较判断反应进行的方向.
解答 解:(1)①脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质为氮气和水,反应的化学方程式:4NH3+6NO=5N2+6H2O,
故答案为:4NH3+6NO=5N2+6H2O;
②Ⅰ.4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;
Ⅱ.4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1.
结合盖斯定律计算,(Ⅱ×5-Ⅰ×3)×$\frac{1}{2}$得到上述脱硝反应的热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1811.63kJ•mol-1,
反应△H<0,△S>0,则△H-T△S<0,反应一定能自发进行,
故答案为:-1811.63kJ•mol-1;能;
③4NH3+6NO=5N2+6H2O反应中反应中氧化剂NO,还原剂为NH3物质的量之比6:4=3:2,每生成3mol还原产物电子转移12e-,每生成1mol还原产物,则反应中转移电子数为4mol,
故答案为:3:2;4;
(2)①由图,0~10min内甲容器中N2O5的浓度变化量为0.2mol•L-1,2NO2(g)+O3(g)?N2O5(g)十O2(g),则消耗O3浓度0.2mol/L,反应速率v(O3)=$\frac{0.2mol/L}{10min}$=0.02mol/(L•min),
故答案为:0.02;
②由图象可知,乙先达到平衡,平衡后N2O5(g)浓度比甲小,根据先拐先平数值大,则乙的温度较高,T1<T2,平衡逆向移动,即正反应是放热反应,△H<0,
2NO2(g)+O3(g)?N2O5(g)十O2(g)
起始量(mol/L) 2 1 0 0
变化量(mol/L) 1 0.5 0.5 0.5
平衡量(mol/L) 1 0.5 0.5 0.5
平衡常数K=$\frac{0.5×0.5}{{1}^{2}×0.5}$=0.5L•mol-1,
故答案为:<;0.5L•mol-1;
③2NO2(g)+O3(g)?N2O5(g)+O2(g),△H<0,
A.恒容容器中,向容器中充入He,增大容器的总压强,分压不变,平衡不变,NO2转化率不变,故A错误;
B.反应为放热反应,升高容器的温度,平衡逆向进行,NO2转化率减小,故B错误;
C.向容器中再充人一定量的NO2,平衡正向进行,但NO2转化率减小,故C错误;
D.向容器中再充入lmol O3和2mo NO2,相当于增大压强,平衡正向进行,NO2转化率增大,故D正确;
故答案为:D;
④若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,计算浓度商Qc=$\frac{2×2}{{2}^{2}×1}$相当于加入五氧化二氮反应逆向进行,则脱硝反应达到平衡前,v(正)<v(逆),
故答案为:<.
点评 本题考查了热化学方程式书写和盖斯定律计算、氧化还原反应电子转移、化学反应速率和平衡常数计算、影响化学平衡的因素,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| B. | 石油是混合物,其分馏产品汽油为纯净物 | |
| C. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 | |
| D. | 石油分馏可获得乙酸、苯及其衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.015 | B. | 0.225 | C. | 0.035 | D. | 0.045 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HDO与H2O化学性质不同 | |
| B. | 用漂粉精和洁厕灵(主要成分是盐酸)混合后的浓溶液清洗马桶效果更佳 | |
| C. | 工业上最理想的化学反应是原子利用率达到100%的反应 | |
| D. | 新原子的发现意味着新元素的合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:Li+<O2-<F-<Na+ | B. | 电负性:F>N>O>C | ||
| C. | 分子中的键角:CO2>H2O>CH4>NH3 | D. | 共价键的键能:H-F>H-Cl>H-Br>H-I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
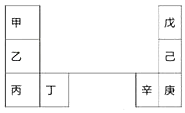 甲~辛等元素在周期表中的相对位置如表.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质.下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质.下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙和庚的原子核外电子数相差11 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
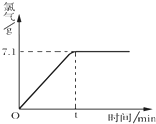 氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电.生成氯气的质量与时间的关系如图所示.请计算:
氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电.生成氯气的质量与时间的关系如图所示.请计算:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com