
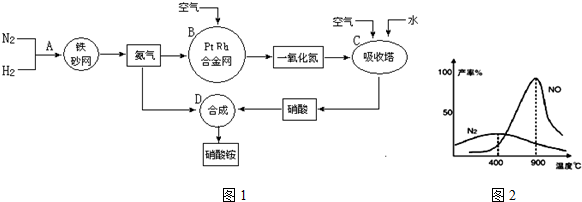
分析 (1)氨合成反应是气体体积减小的放热反应,在氨合成塔适宜的压强是20~50MPa,如果压强过大,除对设备要求高外,还会导致的结果是压碎催化剂,缩短催化剂寿命;
(2)合成硝酸的吸收塔内填充瓷环,其作用是增大气液接触面积,吸收塔中还需补充空气的目的是可使NO全部转化成HNO3;
(3)若输送NH3的管道某处发生泄漏,由于氨气的水溶液显碱性,会使湿润的红色石蕊试纸变为蓝色,所以用湿润的红色石蕊试纸检测;
(4)在一定温度和压强的密闭容器中,将物质的量之比为3:2的H2和N2混合,当该反应达到平衡时,测出平衡混合气中氨的体积分数为25%,假设反应的N2的体积是x,则反应的氢气的体积是3x,反应产生的NH3的体积是2x,按照三段法计算转化率;
(5)制硝酸氧化炉中氨气和氧气在145℃就开始反应,在不同温度和催化剂条件下生成不同产物,根据图示可知,在温度较低时以生成N2为主,900℃时氨气被氧化产生NO,发生主要反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度,化学平衡向吸热的逆反应方向移动,使反应物NH3转化率下降;
(6)N2、H2合成氨时,N2+3H2$\frac{\underline{催化剂}}{△}$2NH3,根据上述分析利用化学方程式计量数计算,详细见解答.
解答 解:(1)氨合成反应是气体体积减小的放热反应,在氨合成塔适宜的压强是20~50MPa,如果压强过大,除对设备要求高外,还会导致的结果是压碎催化剂,缩短催化剂寿命,
故答案为:压碎催化剂,缩短催化剂寿命;
(2)合成硝酸的吸收塔内填充瓷环,其作用是增大气液接触面积,吸收塔中还需补充空气的目的是可使NO全部转化成HNO3,
故答案为:增大气液接触面积;可使NO全部转化成HNO3;
(3)若输送NH3的管道某处发生泄漏,由于氨气的水溶液显碱性,会使湿润的红色石蕊试纸变为蓝色,所以用湿润的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处,
故答案为:用湿润的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处;
(4)在一定温度和压强的密闭容器中,将物质的量之比为3:2的H2和N2混合,当该反应达到平衡时,测出平衡混合气中氨的体积分数为25%,假设反应的N2的体积是x,则反应的氢气的体积是3x,反应产生的NH3的体积是2x,此时H2的物质的量是(3-3x),N2是(2-x),所以2x÷[2x+(3-3x)+(2-x)]=25%,解得x=0.5,所以此时H2的转化率为(3×0.5)÷3=50%,
故答案为:50%;
(5)制硝酸氧化炉中氨气和氧气在145℃就开始反应,在不同温度和催化剂条件下生成不同产物,根据图示可知,在温度较低时以生成N2为主,900℃时氨气被氧化产生NO,发生主要反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度,化学平衡向吸热的逆反应方向移动,使反应物NH3转化率下降,
故答案为:N2;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;生成NO的反应为放热反应,升高温度,平衡向逆反应方向移动,NO的产率下降;
(6)N2、H2合成氨时,N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;H2的转化率为60%,10tH2的物质的量是n(H2)=5×106mol;合成氨气的物质的量是n(NH3)=5×106mol×60%×2/3=2×106mol;假设用于催化氧化制HNO3的氨的物质的量是x,由于氨的损失20%,所以产生的硝酸的物质的量是(1-20%)x,与硝酸反应的氨的物质的量是(1-20%)x,(1-20%)x+x=2×106mol,x=1.11×106mol,反应产生的硝酸铵的质量是m(NH4NO3)=(1-20%)x×80g/mol=1.11×106mol×80%×80g/mol=71.1×106g=71.1吨,
故答案为:71.1.
点评 本题主要考查了工业合成氨与制备硝酸,同时考查了化学平衡计算,综合性较强,题目难度中等,正确理解各物质之间的反应是解题的关键,对学生分析问题和解决问题的能力要求较高.


科目:高中化学 来源: 题型:选择题
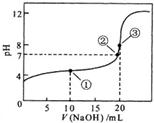 常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000mol/L CH3COOH溶液的滴定曲线如图.下列说法不正确的是( )
常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000mol/L CH3COOH溶液的滴定曲线如图.下列说法不正确的是( )| A. | 点①所示溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
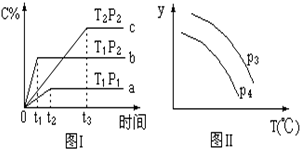
| A. | P3<P4,y轴表示A的转化率 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. | 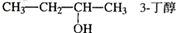 | ||
| C. | 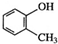 甲基苯酚 甲基苯酚 | D. | 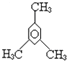 1,3,5-三甲基苯 1,3,5-三甲基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M元素位于周期表中的第三周期第VIA族 | |
| B. | Z元素是硅,其在自然界中存在游离态 | |
| C. | X与M的单质在高温下反应得到的二元化合物分子中,存在极性共价键 | |
| D. | 四种元素中的Y单质可用于航空航天合金材料的制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的摩尔质量(以g/mol为单位)与NA 个磷酸分子的质量(以g为单位)在数值上相等 | |
| B. | NA个氮分子和NA个氢分子的质量比等于14:1 | |
| C. | 1 mol CH3+(碳正离子)中含有电子数为10 NA | |
| D. | 32g氧气所含的氧原子数目为2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com