
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L1的NaOH溶液分别滴定10.00 mL浓度均为0.100 mol·L1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
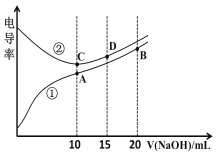
A.曲线①代表滴定HCl溶液的曲线
B.A点溶液中:c(CH3COO)+c(OH)c(H+)=0.1 molL1
C.在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A
D.D点溶液中:2c(Na+)=3c(Cl)
【答案】D
【解析】溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,导电能力弱,电导率小,随着NaOH溶液滴入,生成强电解质CH3COONa,溶液中离子浓度增大,溶液导电性增强;HCl是强电解质,随着NaOH溶液滴入,发生反应HCl+NaOH== NaCl+H2O,离子的总物质的量几乎没变,但溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当恰好完全反应时离子浓度最小,继续加入NaOH溶液,离子浓度逐渐增大,溶液导电能力增强,对照图像可知,曲线②代表0.1 molL1 NaOH溶液滴定HC1溶液的滴定曲线,曲线①代表0.1 molL1NaOH溶液滴定CH3COOH溶液的滴定曲线。A.由分析可知,曲线①代表滴定CH3COOH溶液的曲线,故A错误;B.A点溶液中c(Na+)=0.05 molL1,根据电解质溶液中电荷守恒得c(CH3COO)+c(OH)c(H+)=c(Na+)= 0.05 molL1,故B错误;C.酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl,A点溶质为醋酸钠,促进水电离,B点为等物质的量浓度的醋酸钠和NaOH,NaOH抑制水的电离,所以在相同温度下,水的电离程度:B<C<A,故C错误;D.D点为15 mL 0.100 mol·L1NaOH溶液与10 mL10.00 mL盐酸的混合溶液,所以n(Na+):n(Cl)=3:2,即2c(Na+)=3c(Cl),故D正确。


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的一组离子是
A.Ag+、Ca2+、Cl-、Br- B.I-、H+、SO42-、 ClO-
C.Al3+、NH4+、Cl-、CO32- D.K+、Mg2+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于NaCl晶体的堆积方式的说法中正确的是 ( )
A. 可以看成是Na+按面心立方方式进行最密堆积,Cl-填在Na+形成的空隙中
B. 可以看成是Cl-按面心立方方式进行最密堆积,Na+填在Cl-形成的空隙中
C. 可以看成是Cl-按六方方式进行最密堆积,Na+填在Cl-形成的空隙中
D. 由于离子键有方向性和饱和性,NaCl晶体中的阴阳离子不服从紧密堆积原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
一 | ① | |||||||
二 | ② | ③ | ④ | ⑤ | ||||
三 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
四 | ⑩ |
(1)表中最活泼的金属是________,非金属性最强的元素是________(填元素符号);
(2)⑦的氢氧化物与⑥的最高价氧化物的水化物反应的化学方程式:
_____________________________________________________。
(3)⑧⑨两种元素形成的化合物的最高价含氧酸的酸性强弱顺序是⑧_____⑨。
(4)①③两种元素形成的化合物的水溶液显_____(填“酸”、“中”或“碱”)性。
(5)④⑧两种元素所形成的气态氢化物中较不稳定的是___________(用化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是
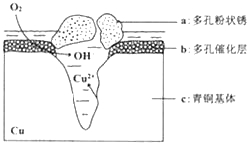
A.腐蚀过程中,负极是c
B.正极反应是 O2+4e+2H2O==4OH
C.若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224 L(标准状况)
D.环境中的Cl扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH+Cl==Cu2(OH)3Cl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重水(D2O)是重要的核工业原料,下列说法错误的是()
A. 重水是原子反应堆的导热剂
B. 氘(D)原子核内有1个中子
C. H2O与D2O的物理性质不相同
D. 1H、D与16O、18O形成的水分子,其相对分子质量不相同的有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。
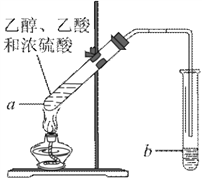
(1)乙酸分子中-COOH原子团的名称是_______。
(2)装置b中通蒸气的导管应置于饱和碳酸钠溶液的液面上而不能插入溶液中,目的是_________________。
(3)浓硫酸的作用是____________、____________。
(4)试管 a 中发生反应的化学方程式为_________________,反应类型是____________。
(5)反应时生成的乙酸乙酯密度比水________,可以闻到_______味。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是一种具有香蕉气味的香精,实验室制备乙酸异戊酯的反应原理、装置示意图和有关数据如下:
【实验原理】

【装置与数据】


【查阅资料】分水器能将反应产生的水从反应体系中分离开来。乙酸乙酯可与无水CaCl2反应。
【实验步骤】
①酯化:在干燥的A中加入6.6异戊醇、9.0g冰醋酸、1.0mL浓硫酸,混匀后放入1~2粒沸石。按图组装好反应装置。检查装置气密性后,缓缓加热A,大约需要1h反应基本完成。
②洗涤:停止加热,冷却后将A中的反应液倒入分液漏斗中,用15mL冷水淋洗烧瓶内壁,洗涤液并入分液漏斗。充分振摇,接通大气静置,分层后分去水层。再用15mL冷水重复操作一次。然后酯层用20mL 5%碳酸氢钠溶液分两次洗涤。最后再用15mL饱和食盐水洗涤一次。
③干燥:将洗涤后的酯层倒入干燥的锥形瓶中,加入2g无水硫酸镁,配上塞子,充分振摇后,放置30min。
④蒸馏:将干燥好的粗酯蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯5.2 g。
回答下列问题:
(1)仪器A的名称为 。球形冷凝管中冷凝水的进口是 (填“a”或“b”)。
(2)从化学平衡的角度分析分水器的作用是 。
(3)分液操作中,充分振荡静置分层后,酯层分离出来的方法是 。
(4)酯层用20mL 5%碳酸氢钠溶液洗涤的现象是 。
(5)干燥时加入的无水硫酸镁不能换成无水CaCl2,理由是 。
(6)本实验的产率为 。
(7)本实验中加入过量乙酸能提高醇的转化率,为何不加入过量的醇从而提高乙酸的转化率?其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com