
【题目】有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀,滤液与4molL﹣1NaOH溶液时恰好完全中和.试求:
(1)混合液H2SO4、HNO3的物质的量浓度各是多少?
(2)另取10mL原混合液稀释至80mL,加入1.92g铜粉共热时,收集到气体在标准状况下的体积为多少毫升?
【答案】
(1)解:硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀为硫酸钡,
硫酸根守恒故n(H2SO4)=n(BaSO4)= ![]() =0.04mol,故原溶液中c(H2SO4)=
=0.04mol,故原溶液中c(H2SO4)= ![]() =4mol/L;
=4mol/L;
滤液中氢离子物质的量不变,与4.0molL﹣1NaOH溶液反应,用去40mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH﹣1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),即n(HNO3)+2×0.04mol=0.04L×4mol/L,解得n(HNO3)=0.08mol,故原溶液中c(HNO3)= ![]() =8mol/L,
=8mol/L,
答:混合液中H2SO4的物质的量浓度为4mol/L、HNO3的物质的量浓度是8mol/L;
(2)解:1.92g铜粉物质的量为0.03mol,溶液中氢离子的物质的量为10×10﹣3×(4×2+8×1)mol=0.16mol,根据离子方程式:
3Cu+8H++2NO ![]() =3Cu2++2NO↑+4H2O,
=3Cu2++2NO↑+4H2O,
3mol 8mol 44.8L
0.03mol 0.16mol V
由此可知氢离子过量,则 ![]() =
= ![]() ,
,
解得V=0.448L,
答:收集到气体在标准状况下的体积为0.448L.
【解析】(1)酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀为硫酸钡,根据n= ![]() 计算硫酸钡的物质的量,再根据硫酸根守恒n(H2SO4)=n(BaSO4),滤液中氢离子物质的量不变,与4.0molL﹣1NaOH溶液反应,用去40mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH﹣1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),根据c=
计算硫酸钡的物质的量,再根据硫酸根守恒n(H2SO4)=n(BaSO4),滤液中氢离子物质的量不变,与4.0molL﹣1NaOH溶液反应,用去40mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH﹣1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),根据c= ![]() 计算硫酸、硝酸的物质的量浓度;(2)根据离子方程式:3Cu+8H++2NO
计算硫酸、硝酸的物质的量浓度;(2)根据离子方程式:3Cu+8H++2NO ![]() =3Cu2++2NO↑+4H2O,先判断过量问题,再利用量少的完全反应计算.
=3Cu2++2NO↑+4H2O,先判断过量问题,再利用量少的完全反应计算.


科目:高中化学 来源: 题型:
【题目】M,N,X,Y四种短周期主族元素在元素周期表中的相对位置如图所示.已知它们的原子序数总和为48,则下列有关说法中不正确的是( ) ![]()
A.N与X位于元素周期表中ⅥA族
B.M,X,Y三种元素的最高价氧化物对应的水化物均为强酸
C.M,N,X,Y均位于金属与非金属的分界线上
D.M的气态氢化物与Y的气态氢化物反应,可生成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础。下列有关实验装置进行的相应实验,不能达到实验目的的是

图1 图2 图3 图4
A. 用图1所示装置吸收多余的Cl2
B. 用图2所示装置蒸发NaCl饱和溶液制备NaCl晶体
C. 用图3所示装置制取少量纯净的CO2
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2NaOH+Br2===NaBr+NaBrO+H2O,若从溴水中把溴萃取出来,可选用的萃取剂是( )
A. 食盐饱和溶液B. 无水酒精C. 四氯化碳D. 氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有甲、乙两种成分:![]()
(1)①用酸性高锰酸钾溶液检验甲和乙中含有碳碳双键,方案是否可行(填“可行”或“不可行”).
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式 .
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液呈现紫色
(2)由甲转化为乙的过程为(已略去无关产物):甲 ![]()
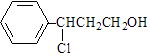
![]()
![]() 乙
乙
Y的结构简式 , 设计步骤Ⅰ的目的是 .
(3)1mol乙最多可与 mol H2发生加成反应.
(4)写出乙与新制Cu(OH)2悬浊液反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据;
(2)用离子方程式表示除去固体产物中Al2O3的原理;
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①C (s)+ ![]() O2(g)═CO (g)△H=﹣110.5kJmol ﹣1
O2(g)═CO (g)△H=﹣110.5kJmol ﹣1
②C (s)+O2 (g)═CO2 (g)△H=﹣393.51kJmol ﹣1
则反应:C (s)+CO2(g)═2CO (g) 的△H为( )
A.﹣283.01 kJmol ﹣1
B.+504.00 kJmol ﹣1
C.+283.01 kJmol ﹣1
D.+172.51 kJmol ﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:下列说法中正确的是( ) 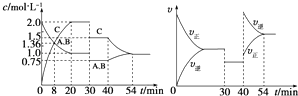
A.30~40 min 间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30 min 时降低温度,40 min 时升高温度
D.30 min时减小压强,40 min时升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使甲基橙呈红色的溶液中:K+、AlO2﹣、NO3﹣、CO32﹣
B.c(ClO﹣)=1.0 mol?L﹣1溶液:Na+、SO32﹣、S2﹣、Cl﹣
C.水电离出来的c(H+)=1×10﹣12的溶液:K+、NH4+、SO42﹣、Fe3+
D.![]() =0.1 mol?L﹣1的溶液:Na+、AlO2﹣、CO32﹣、NO3﹣
=0.1 mol?L﹣1的溶液:Na+、AlO2﹣、CO32﹣、NO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com