
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的底部 | |
| B. | 定容时,因不慎使液面高于容量瓶的刻度线,可用滴管将多余液体吸出 | |
| C. | 焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后再进行实验 | |
| D. | 过滤时,为加快过滤速率,可用玻璃棒快速搅拌漏斗中的悬浊液 |
分析 A.蒸馏时,测定馏分的温度;
B.定容时不慎使液面高于容量瓶的刻度线,实验失败;
C.盐酸清洗,灼烧时不会造成干扰;
D.过滤时不能搅拌.
解答 解:A.蒸馏时,测定馏分的温度,则应使温度计水银球位于烧瓶支管口处,故A错误;
B.定容时不慎使液面高于容量瓶的刻度线,实验失败,应重新配制,故B错误;
C.盐酸清洗,灼烧时不会造成干扰,则先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后再进行实验,故C正确;
D.过滤时不能搅拌,将滤纸捣破,过滤操作失败,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意焰色反应中操作步骤,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
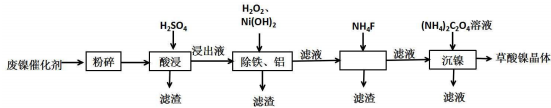
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni3+ | 6.7 | 9.5 |
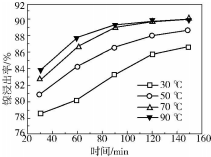
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
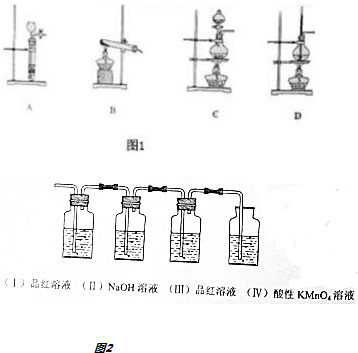
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则一定有NH4+ | |
| B. | 加入氯化钡有白色沉淀产生,再加盐酸,沉淀不消失,该溶液一定有SO42- | |
| C. | 加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,则原溶液中一定有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
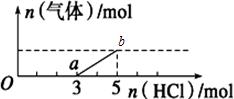
| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 标准状况下,通入CO2的体积为4.48L | |
| C. | ab段反应的离子方程式为:HCO${\;}_{3}^{-}$+H+=CO2↑+H2O | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
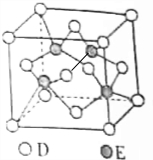 原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.
原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol•L-1 CH3COOH溶液 | |
| B. | 10-3 mol•L-1 H2SO4浓缩到原体积的10倍. | |
| C. | pH=1的H2SO4溶液稀释10倍 | |
| D. | c(OH-)=10-2 mol•L-1 的某溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com