
| A. | 生物柴油具有良好的燃料性能,属于烃类,安全、环保、可再生 | |
| B. | 油脂是人类维持生命活动所需能量的主要来源 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
分析 A.生物柴油是以油脂为原料,通过水解、酯化所得高级脂肪酸甲酯;
B.糖类是人类维持生命活动所需能量的主要来源;
C.PM2.5是指空气中固体颗粒物;
D.强紫外线能使皮肤蛋白质变性.
解答 解:A.生物柴油具有良好的燃料性能,且安全、环保、可再生,它的成分是高级脂肪酸甲酯,故A错误;
B.糖类是人类维持生命活动所需能量的主要来源,脂肪为储能物质,故B错误;
C.PM2.5是指空气中固体颗粒物,而氮氧化物和硫氧化物为气体污染物,故C错误;
D.强紫外线能使皮肤蛋白质变性,则登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性,故D正确;
故选D.
点评 本题考查物质的性质、用途,为高频考点,把握物质的性质、发生的反应及化学与生活等为解答该题的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
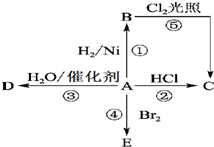 某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A也是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据该图回答下列问题:
某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A也是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据该图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H和2H是不同的核素,它们的中子数相同 | |
| B. | 6Li和7Li的质子数相等,电子数也相等 | |
| C. | 14C和14N的质子数不等,它们的中子数相等 | |
| D. | 13C和14C属于同一种元素,它们的质量数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工作时Zn 电极质量减少 | B. | Zn 是负极,Ag2O 是正极 | ||
| C. | 工作时溶液中电子由Ag2O 流向Zn | D. | 溶液中氢氧根离子向Zn 电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和N2 | B. | O3和NO2- | C. | N2H4和C2H4 | D. | CO2和N2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
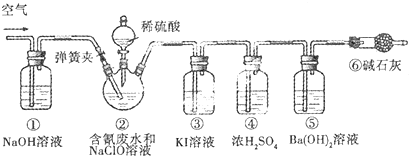

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
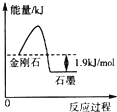 根据表中的信息判断下列说法错误的是( )
根据表中的信息判断下列说法错误的是( )| 物质 | 外观 | 燃烧热/(kJ•mol-1) |
| 金刚石 | 无色、透明固体 | 395.4 |
| 石墨 | 灰黑,不透明固体 | 393.5 |
| A. | 由表中信息可得如图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1 | |
| C. | 由表中信息可知相同条件下金刚石的熔点低于石墨的熔点 | |
| D. | 石墨燃烧热的热化学方程式为C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-393.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸的氧化性强于稀硝酸 | |
| B. | 与冷水反应的速率:Na>Mg | |
| C. | 向淀粉KI溶液中滴入溴水,溶液变蓝 | |
| D. | 原子半径:Al>Si>P |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
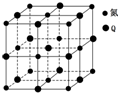 X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为nsnnp2n;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族.
X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为nsnnp2n;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com