
在用标准氢氧化钠溶液滴定待测盐酸的中和滴定实验中,下列操作(其他操作正确)会造成测定结果偏低的是( )
A.滴定前平视读数,终点读数时仰视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后又用待测盐酸润洗
D.称量前NaOH固体中混有Na2CO3固体
科目:高中化学 来源: 题型:
| 次数 | 滴定前(mL) | 滴定后(mL) |
| 1 | 0.40 | 21.10 |
| 2 | 0.10 |
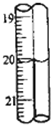 第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为
第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
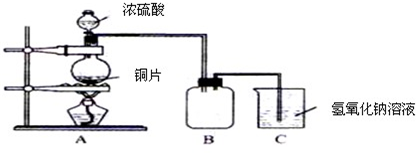
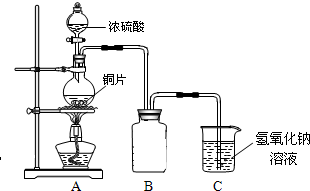 (2011?绵阳模拟)某化学兴趣小组为探究
(2011?绵阳模拟)某化学兴趣小组为探究
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com