
| A. | 114号元素在周期表中第七周期第VIA族,属于金属元素 | |
| B. | 晶体硅熔点高硬度大,可用于制作光导纤维 | |
| C. | 为了除去MgCl2酸性溶液中的Fe3+而得到较纯净的MgCl2溶液,可在加热搅拌的条件下加入MgCO3,过滤后,再向滤液中加入适量的盐酸 | |
| D. | 光束通过下列分散系①有尘埃的空气②明矾溶液③墨水④稀豆浆时,都能产生丁达尔效应 |
分析 A.根据元素的电子层数和最外层电子数确定其在周期表中的位置;
B.光导纤维主要成分是二氧化硅;
C.除去MgCl2酸性溶液中的Fe3+,可利用影响铁离子水解的平衡移动因素角度解答;
D.丁达尔效应是胶体特有的性质.
解答 解:A.114号元素的核外电子排布为:2、8、18、32、32、18、4,其核外有7个电子层,最外层为4,所以位于第七周期第IVA族,属于金属元素,故A错误;
B.光导纤维主要成分是二氧化硅,不是硅,故B错误;
C.Fe3+水解溶液显酸性,Fe3++3H2O?Fe(OH)3+3H+,在加热搅拌的条件下加入碳酸镁,水解吸热,加热搅拌的条件促进水解,碳酸镁和氢离子反应生成镁离子和CO2,使三价铁离子的水解平衡向正反应方向移动,使三价铁离子变成氢氧化铁沉淀除去,同时实现将杂质转化为纯净物,故C正确;
D.光束通过胶体分散系才能产生丁达尔效应,明矾溶液不是胶体,不能 产生丁达尔效应,故D错误;
故选:C.
点评 本题考查化学实验方案的评价,掌握原子结构与元素周期表结构关系、胶体的性质、盐类水解的应用是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
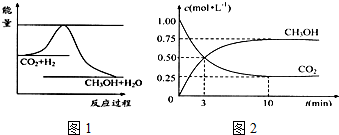
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C≡O | H-O | H-H | C═O |
| E/(kJ.mol-1) | a | b | c | d |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
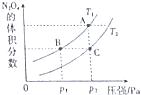
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | Y | ||
| W | Z |
| A. | X、Y、Z三种元素气态氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | W、X、Z三种元素最高价氧化物对应的水化物的酸性依次增强 | |
| D. | W、X、Z三种元素最高正化合价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
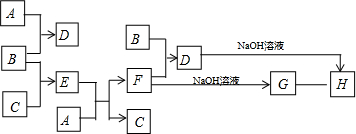
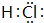 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
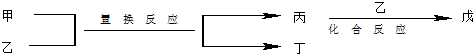
| 选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
| NH3 | O2 | NO | H2O | NO2 | |
| Mg | CO2 | C | MgO | CO | |
| C | H2O | CO | H2 | CO2 | |
| FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阴离子符号 | 物质的量浓度(mol•L-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Z元素在反应①中被还原,在反应③中被氧化 | |
| B. | 反应Z2+2A2+═2A3++2Z-可以进行 | |
| C. | 氧化性由强到弱的顺序是XO4-,Z2,B2,A3+ | |
| D. | 还原性由强到弱的顺序是Z-,B-,A2+,X2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com