
| A. | [HCN]<[CN-] | B. | [Na+]<[CN-] | ||
| C. | [HCN]-[CN-]=[OH-] | D. | [HCN]+[CN-]=0.1mol•L-1 |
分析 将0.2 mol•L-1 HCN溶液和0.1 mol•L-1的NaOH溶液等体积混合后,所得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,由于混合后溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,结合电荷守恒和物料守恒解答该题.
解答 解:A.混合后得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,故c(HCN)>c(CN-),故A错误;
B.据电荷守恒可知c(H+)+c(Na+)=c(CN-)+c(OH-),溶液显碱性,则c(OH-)>c(H+),则c (Na+)>c (CN-),故B错误;
C.由物料守恒可知c(HCN)+c(CN-)=2c(Na+),又据电荷守恒可知c(H+)+c(Na+)=c(CN-)+c(OH-),二者联式可得2c(H+)+c(HCN)+c(CN-)=2c(CN-)+2c(OH-),则2c(H+)+c(HCN)=c(CN-)+2c(OH-),c(HCN)-c(CN-)=2c(OH-)-2c(H+),故C错误;
D.由物料守恒可知:c(HCN)+c(CN-)=0.1mol•L-1,故D正确;
故选D.
点评 本题考查了混合溶液中离子浓度大小的判断,为高考常见题型,题目难度中等,试题侧重于学生的分析能力的考查,注意电荷守恒和物料守恒的运用,把握盐类水解的特点为解答关键.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 完全燃烧20g甲醇,生成二氧化碳和液态水时放出的热量为908.3 kJ | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)a=-1453.28 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
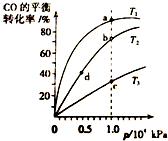 用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A. | 温度:T1>T2>T3 | B. | 正反应速率:v(a)>v(c) v(b)>v(d) | ||
| C. | 平衡常数:K(a)>K(b) K(b)=K(d) | D. | 平均摩尔质量:M(a)>M(c) M(b)<M(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③⑥ | C. | ③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是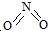 和
和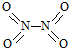 .实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.
.实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液先变红色后褪色 | 证明有氯水具有酸性 |
| B | 将Cl2通入NaBr溶液中,溶液变黄 | 比较氯气比液溴的氧化性强 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 证明氧化性:Cu2+>Fe3+ |
| D | 向某待测溶液中,加入BaCl2溶液,产生白色沉淀,继续滴加稀盐酸,沉淀不消失 | 证明待测溶液中含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com